
Posttransfusionssiderose 
Am meisten Eisen wird Patienten durch Bluttransfusionen zugeführt, mit jeder Einheit transfundierten
Erythrozytenkonzentrates etwa 200 mg Eisen zugeführt. Die durchschnittliche tägliche Eisenzufuhr eines
regelmäßig transfundierten Thalassämiepatienten beträgt damit etwa 0,4-0,6 mg/kg. Da überschüssiges
Eisen aktiv nicht ausgeschieden werden kann, kommt es z.B. bei einem 12-jährigen Patienten mit ß-
Thalassämia major unter regelmäßiger Transfusionstherapie kommt es zur Akkumulation von mehr als 55
g Eisen in Geweben, die normalerweise insgesamt nur ca. 2 g Eisen enthalten (15). Unter den
Bedingungen einer regulär geführten Transfusionstherapie ist mit einer Organschädigung ab einer
zugeführten Menge von 500 g Erythrozyten/kg – das entspricht etwa 500 mg Eisen/kg – zu rechnen (16).
Vor der Ära der Transfusionstherapie betrug die Lebenserwartung von Kindern mit schweren
Hämoglobinopathien oft nur wenige Jahre. Unter einer chronischen Transfusionstherapie ergibt sich
allerdings mit der sich entwickelnden progressiven Eisenüberladung ein neues lebensbedrohliches
Problem. Ohne eine entsprechende Therapie mit Eisenchelatoren kommt es z.B. bei ß-Thalassämie
major zu endokrinen Folgeschäden, Leberfibrose und -zirrhose und die meisten Patienten versterben in
der zweiten Lebensdekade an einer Herzinsuffizienz infolge der kardialen Hämosiderose (17). 
Nutritiv bedingte Eisenüberladung? 
Der auch in aktuellen Publikationen häufig zitierte Begriff des „Mukosa-Block“ wurde ursprünglich vor 65
Jahren formuliert, um die Herunterregulation der intestinalen Eisenabsorption als Reaktion auf eine
vorangegangener Eisengabe bei Versuchstieren zu beschreiben (18). Ob es diesen Effekt beim
Menschen überhaupt gibt, ist allerdings eher fraglich. So funktioniert eine orale Therapie mit täglichen
Eisen-Dosis bekanntermaßen gut und der „Mukosa-Block“ schützt auch keineswegs vor einer akuten
Intoxikation durch sehr hohe Eisendosen. So kann eine Einnahme von 180–300 mg Fe/kg
Körpergewicht tödlich sein. Eine Dosis von 10-20 mg Fe/kg gilt als nicht-akut-toxisch beim Menschen.
Zutreffender ist es, von einer „Mukosa_Block-Intelligenz“ zu sprechen, die die Eisenabsorption nach dem
Bedarf an Eisen im Körper reguliert. Mit der Regulation der Hepcidinsynthese kennen wir heute einen
Mechanismus, der für diese Intelligenz verantwortlich ist. In einer aktuellen Arbeit fanden z.B. Roe et al.
retrospektiv in Serum-Proben aus einer Eisenabsorptionsstudie mit 54Fe und 57Fe markierten
Testmahlzeiten, dass interindividuelle Schwankungen in der Eisenabsorption zumindest teilweise mit
den Plasmahepcidin-Spiegeln erklärt werden können (19).
In der Literatur wird heute diskutiert, wie effizient diese „Mukosa-Block-Intelligenz“ beim Menschen
wirklich funktioniert, und ob eine hohe Eisenzufuhr auf Dauer nicht unweigerlich zu einer exzessiven
Eisenspeicherung führen muss (20,21). Als Beispiel wird oft die historisch interessante Bantu-Siderose
angeführt, die durch das tägliche Trinken von großem Mengen traditionell in Eisentöpfen gebrauten Biers
in Nordafrika hervorgerufen wurde. Man hat die zugeführten Mengen an Eisen auf 50-100 mg/Tag
kalkuliert, was häufig zu Leberzirrhose, Diabetes und Herzinfarkten führen kann. Durch Verwendung von
Edelstahl- oder Kunststoffgefäße konnte dieses Problem leicht gelöst werden. Einschränkend muss
angeführt werden, dass Alkohol einen direkten Einfluss auf Eisenabsorption haben kann. Neuere Studien
legen auch eine genetische Ursache der Afrikanischen Siderose nahe, obwohl ein definierter Gendefekt
bisher nicht gefunden werden konnte (22). Aus den Erfahrungen mit der Bantu-Siderose kann man mit
einem Sicherheitsfaktor von 2 das obere Limit für eine Nahrungseisenzufuhr mit 25-50 mg/Tag festlegen.
Im Rahmen von z.B. Eisenfortifizierungsprogrammen zur Eisenmangelprophylaxe wird deshalb immer
wieder vor adversen Effekten gewarnt (23). Besonders gefährdet erscheinen Genträger für die C282Y-
Mutation zu sein (Häufigkeit in der Normalbevölkerung ca. 10 %), da diese etwas vermehrt Eisen aus
einer normalen Diät aufnehmen können. In Studien mit markierten Testmahlzeiten hat man diesen Effekt
allerdings bisher nicht eindeutig nachweisen können. Auch sprechen epidemiologische Erkenntnisse aus
vielen Studien über Hämochromatosepatienten eher dagegen, denn Genträger entwickeln im Laufe des
Lebens nur in ganz wenigen Ausnahmefällen deutlich erhöhte biochemische Parameter einer
Eisenüberladung und zeigen so gut wie nie klinische Symptome einer Hämochromatose (24).
In diesem Zusammenhang muss auch die „Eisen-Hypothese“ erwähnt werden, die breiten Raum in der
Literatur und in Diskussionen im Internet einnimmt und nach der erhöhte Eisenspeicher als Risikofaktor
für verschiedene Krankheiten (koronare Herzkrankheit, Diabetes, neurodegenerative Erkrankungen)
angesehen werden. In vielen Studien werden dabei erhöhte Serum-Ferritin-Werte als Surrogat-Marker für
ein eiseniduziertes Risiko für Zell- und Organschäden am Patienten angeführt (20,21). Das wichtigste
Argument gegen diese „Ferritin-basierte Eisen-Hypothese“ ist, dass Serum-Ferritin als akut-phase-
Protein bei vielen Krankheiten sekundär erhöht vorliegt und deshalb nicht zuverlässig erhöhte
Eisenspeicher anzeigen kann. Ob diese Patienten wirklich leicht erhöhte Eisenspeicher haben und ob
hier Eisen als Co-Faktor eine Rolle spielt, konnte bisher weder schlüssig nachgewiesen noch eindeutig
ausgeschlossen werden. Unzählige Versuchen an Zellkulturen und in Tierversuchen unter
Eisenüberladung weisen nach, wie Eisen in Zellen akkumulieren und zu vermehrten Schäden durch
oxidativem Stress führen kann. Klar ist aber auch, dass wir antioxidative Abwehrstrategien haben, die
durch Eisenüberladung sogar stimuliert werden können und vermehr zur Verfügung stehen können.
Zusammenfassend ist damit die eigentlich relevante Frage: Mit wie viel Eisen können unsere
antioxidativen Mechanismen auf Dauer umgehen? Klinische Erfahrungen bei Patienten mit teilweise
jahrzehntelang schwerer Eisenüberladung (Hämochromatose, ß-Thalassämie) zeigen keine statistische
Häufung von z.B. Herzinfarkten oder Krebserkrankungen (6,9,10). Bei einzelnen Patienten kann die es
aber zu einer gefährlichen Dekompensation in bestimmten Organen kommen (unbeherrschbarer
Diabetes, Herzversagen bei ß-Thalassämie; primäres hepatozelluläres Carcinom bei Patienten mit
vorhandener Leberzirrhose). Bricht man diese Erfahrungen auf das Risiko in der Normalbevölkerung
herunter, dann kann die Wirkung von leicht erhöhten Eisenspeicher eigentlich nur sehr gering sein.
Eisenüberladung durch orale Eisentherapie?
Bei therapeutischen Dosen einer oralen Eisentherapie (50-100 mg Fe/Einzeldosis) werden 5-20 %
absorbiert. 80-95 % verbleiben längere Zeit im Darmlumen und können dort Auslöser vielerlei
Reaktionen werden. Abhängig von Einzel- und Tagesdosis (> 50-100 mg/Tag), äußert sich dies bei
Patienten in den typischen Eisennebenwirkungen wie Übelkeit, Krämpfe, Schmerzen, Durchfall,
Verstopfung. Eine zweite Art von Nebenwirkung, vom Patienten meist nicht direkt bemerkt, in
vermehrtem oxidativen Stress in entzündlichen Darmgewebe bei M-. Crohn und Colitis Ulcerosa (25). Ein
Zusammenhang zwischen einer Eisensupplementation und dem Risiko für Darmkrebs ist unklar und sehr
umstritten.
Eine dritte Art von chronischer adverser Reaktion bei einer langandauernden Eisensupplementation ist
die Ausbildung einer sekundären Eisenüberladung: Ingesamt scheint dies nicht häufig vorzukommen, es
gibt dazu nur Einzelfallberichte (26). Bis 1996 war nicht klar, ob es sich dabei um Fälle einer
unentdeckten hereditären Hämochromatose handeln könnte. Barton et al. beschrieben 2006 vier Fälle,
bei den explizit auch auf genetische Veränderung (HAMP, HFE, TfR2, FPN1, HJV, ALAS2) untersucht
wurde (27). In allen Fällen wurde wegen unklarer oder angeblicher Anämie über viele Jahre (7-61 Jahre!)
täglich Eisen oral zugeführt (60-220 mg Fe/Tag). Ein Fall mit ß-Thalassämia minor und homozygoter
C282Y-Mutation (Selbstmedikation mit 60 mg Fe/Tag über 7 Jahre) entwickelte dabei eine schwere
Eisenüberladung, Diabetes, Leberzirrhose und Herzrhythmusstörungen, und musste später mit 160
Aderlässen behandelt werden. Die anderen Fälle hatten deutlich mehr Eisen (547-4898 g) über längere
Zeit (15-61 Jahre) eingenommen, zeigten auch hohe Ferritinwerte (ca. 2000 µg/l), bildeten aber keine
hämochromatose-typische klinische Symptomatik aus. Der Grad der Eisenüberladung, erkennbar an der
Zahl der notwendigen Aderlässe, korrelierte nicht mit der Dauer und Menge der Eiseneinnahme.
Diese Fälle zeigen, dass eine nichtindizierte orale Eisentherapie zu einer Eisenüberladung führen kann,
die im Einzelfall auch eiseninduzierte Organschäden auslösen kann. Nur Patienten mit einem
dokumentierten Eisenmangel sollte daher kontrolliert und über eine begrenzte Zeit Eisen einnehmen.
Eisenüberladung durch parenterale Eisentherapie? 
Bei der Behandlung von Eisenmangel-Patienten findet z.Zt. eine Renaissance der parenteralen
Eisentherapie statt. Es handelt sich dabei um kolloidale Fe(III)- Kohlenhydrat- Nanopartikel, die
vorzugsweise i.v. appliziert werden. Da bei i.v.-Injektion von hochmolekularen Eisenverbindungen die
„Mukosa-Block-Intelligenz“ naturgemäß außer Kraft gesetzt ist, kann es bei wiederholter Anwendung, wie
z.B. bei Patienten mit renaler Anämie unter Epo-Therapie heute durchaus üblich ist, zu einer
Eisenüberladung kommen.
Makrophagen sind an der Plasmaclearance der i.v. applizierten hochmolekularen Substanzen wesentlich
beteiligt, wobei der Metabolismus der jeweiligen Verbindung sehr von der Größe und der Hülle der
kolloidalen Nanopartikel abhängig ist. Dabei wird offenbar nicht die ganze Substanz restlos
metabolisiert und der Erythropoese zur Verfügung gestellt, sondern ein Teil wird z.B. in langlebigen
Zellen in Leber und Knochenmark gespeichert Diese „residuelle Endothelsiderose“ (Hausmann) bleibt
auch in Gegenwart einer Eisenmangelanämie bestehen, was zeigt, dass es sich hierbei um schwer
mobilisierbares Eisen handelt (28). Es ist schon lange bekannt, dass man bei einer histologischen
Begutachtung von Knochenmarkspunktaten denjenigen Patienten leicht identifizieren kann, der in der
Vorgeschichte jemals eine Injektion mit bestimmten Eisenverbindungen erhalten hat. Es wurde deshalb
früher von der leichtfertigen Anwendung einer parenteralen Eisentherapie immer wieder gewarnt (29, 30).
Diese Erkenntnis einer Eisenspeicherung nach i.v. Eisengabe wird gerade wieder neu entdeckt (31).
Diese gleiche Problematik ergibt sich heute auch durch die Anwendung von eisenbasierten Nanopartikeln
in der MRI-Kontrastgebung (z.B. „molekulares Imaging“). Von zugelassenen Präparaten wie Endorem®
oder Resovist® ist diesbezüglich auch sehr wenig bekannt, obwohl teilweise hohe Dosen injiziert werden.
Literatur
15. Giardina PJ, Grady RW. Chelation therapy in betathalassemia: the benefits and limitations of desferrioxamine. Semin
Hematol 1995; 32: 304-312
16. Fosburg M, Nathan D, Wayne A. Desferrioxamine provocative test: methodology for estimating iron and total iron
binding capacity Blood 1990; 76: 2162
17. Aessopos A, Farmakis D, Hatziliami A, Fragodimitri C, Karabatsos F, Joussef J, Mitilineou E, Diamanti-Kandaraki
E, Meletis J, Karagiorga M. Cardiac status in well-treated patients with thalassemia major. Eur J Haematol 2004; 73: 359-
366
18. Hahn PF, Bale WF. Ross IF, Balfour WM, Whipple GH. Radioactive iron absorption by gastro-intestinal tract:
influence of anemia, anoxia, and antecedent feeding. J Exp Med 1943; 78:169-88
19. Roe MA, Heath AM, Oyston SL, Macrow C, Hoogewerff JA, Foxall R, Dainty JR, Majsak-Newman G, Willis G,
Fairweather-Tait SJ. Iron absorption in male C282Y heterozygotes. Am J Clin Nutr 2005;81:814 –21
20. Salonen JT, Nyyssonen K, Korpela H, Tuomilehto. J,. Seppanen. R,. Salonen R. High stored iron levels are
associated with excess risk of myocardial infarction in eastern Finnish men. Circulation 1992; 86(3):803-11
21. Weinberg ED. The role of iron in cancer. Eur J Cancer Prev 1996; 5:19-36
22. Gordeuk VR, Mukiibi J, Hasstedt SJ, Samowitz W, Edwards CQ, West G, Ndambire S, Emmanual J, Nkanza N,
Chapanduka Z, Randall M, Boone P, Romano P, Martell RW, Yamashita T, Effler P, Brittenham G. Iron overload in Afrika.
Interaction between a gene and dietary iron content. N Engl J Med 1992; 326:95-100
23. Schümann K, Ettleb T, Szegnera B, Elsenhans B, Solomons NW. On risks and benefits of iron supplementation
recommendations for iron intake revisited. J Trace Elem Med Biol 2007; 21:147–168
24. Singh M, Ashwell M, Sanderson P, Cade J, Moreton J, Fairweather-Tait S, Roe M, Marx JJ, Worwood M, Cook JD.
Risk of iron overload in carriers of genetic mutations associated with hereditary haemochromatosis: UK Food Standards
Agency workshop. Br J Nutr 2006; 96(4):770-3
25. Erichsen K, Ulvik RJ, Nysaeter G, Johansen J, Ostborg J, Berstad A, Berge RK, Hausken T. Oral ferrous fumarate
or intravenous iron sucrose for patients with inflammatory bowel disease. Scand J Gastroenterol. 2005;40(9):1058-65
26. Green P, Eviatar JM, Sirota P, Avidor I.Secondary hemochromatosis due to prolonged iron ingestion. Isr J Med
Sci. 1989; 25(4):199-201
27. Barton JC, Lee PL, West C, Bottomley SS.Iron overload and prolonged ingestion of iron supplements: clinical
features and mutation analysis of hemochromatosis-associated genes in four cases. Am J Hematol. 2006; 81(10):760-7
28. Hausmann K, Wulfhekel U, Diillmann J, Kuse R. Iron Storage in Macrophages and Endothelial Cells.
Histochemistry, Ultrastructure, and Clinical Significance. Blut 1976; 32: 289-295.
29. Fishbane S. Intravenous iron therapy: reweighing risk and reward. Semin Dialysis. 1999;12:5-8.
30. Besarab A, Frinak S, Yee J: An indistinct balance: the safety and efficacy of parenteral iron therapy. J Am Soc
Nephrol 1999, 10:2029-2043.
31. Thomason RW, Almiski MS. Evidence that stainable bone marrow iron following parenteral iron therapy does not
correlate with serum iron studies and may not represent readily available storage iron. Am J Clin Pathol. 2009
Apr;131(4):580-5. Links












© www.eiseninfo.de
Eisenüberladung (sekundäre)
Sekundär bedingte Eisenüberladung
Unter dem Begriff der sekundären Eisenüberladung wird eine
Reihe von genetisch bedingten oder erworbenen Krankheiten
zusammengefasst, die auch zu einer progressiven
Organsiderose und zu erhöhten Eisenparametern im Blut
führen können. Eine Übersicht ist in Tabelle 3.1 aufgeführt,
wobei in der Literatur unterschiedliche Auflistungen
existieren.Sekundäre Eisenüberladungen
“Iron-loading anemias” mit und ohne Transfusionen
•
Thalassaemia major
•
Kongenitale Dyserythropoetische Anämien 
(CDA)
•
Sideroblastische Anämien
•
Transfusionssiderosen
•
Aplastische Anämien
•
Diamond-Blackfan-Anämie
•
Myelodysplastisches Syndrom
•
Sichelzellkrankheit
andere Formen
•
Nutritive Eisenüberladung
•
Parenterale Eisenüberladung nach i.v. Eisen
•
Chronische Lebererkrankungen
•
Hepatitis C und B
•
Alkohol-induzierte Lebererkrankung
•
Dysmetabolisches Syndrom
Tab. 1: Einteilung der sekundären Eisenüberladungen.
Im Folgenden wird exemplarisch auf einige Formen der
Hämosiderose kurz eingegangen werden.

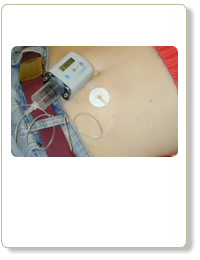
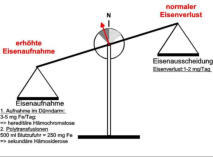
Eisenüberladung
Subkutane Injektion von DesferalR, einem Eisenchelator, der Eisen im Körper mobilisieren und ausscheiden lassen kann
Positive Eisenbilanz durch erhöhte Nahrungseisenaufnahme oder durch
Nahrungseisenaufnahme oder durch chronische Bluttransfusionen.
chronische Bluttransfusionen. 
 Nahrungseisenaufnahme oder durch
Nahrungseisenaufnahme oder durch chronische Bluttransfusionen.
chronische Bluttransfusionen.