Die genaue Erfassung der Größe der Eisenspeicher ist essentiell für die Behandlung von chronisch transfundierten
Patienten mit Eisenchelatoren, um einerseits die Toxizität durch erhöhte Organ-Eisenkonzentrationen und
andererseits Nebenwirkungen durch eine Überdosierung des Chelators zu vermeiden (1).
Die Eisenspeicher können durch direkte und indirekte Methoden erfasst werden. Die Referenzmethode ist dabei die
direkte Messung von nichthäm-Eisen in einer Lebergewebsprobe. Seit der Einführung des Ferritin-Tests (2) sind in
neuerer Zeit eine Reihe von weiteren indirekten (nicht-Transferrin gebundenes Eisen, Hepcidin) und nichtinvasiven
(Magnetresonanz-Tomographie MRI, Biosuszeptometrie) Methoden zur Bestimmung der Eisenspeicher entwickelt
worden (siehe Tabelle 4.1). Viele der indirekten Parameter sind für die quantitative Bestimmung von normalen
Eisenspeichern oder zur Abgrenzung des Eisenmangels durchaus geeignet, aber versagen bei Patienten mit
Eisenüberladung. Zum Beispiel wurde mittels erschöpfender Aderlassbehandlung (quantitative Phlebotomie) in
Normalpersonen die Relation von 8 mg Speichereisen per 1 µg/l Ferritin gefunden (3), die für die Beurteilung einer
Eisenüberladung allerdings unbrauchbar ist.
iopsie 
Herz-Eisen (T2*, investigativ) 
INDIREKTE Parameter 
DIREKTE Parameter (invasiv) 
DIREKTE Parameter (nichtinvasiv) 
Serum -Ferritin 
Leber-Biopsie 
Leber-Eisen (Standard): 
Transferrin-Sättigung
- Histologie (TIS) 
SQUID-Biosuszeptometrie 
Urineisen-Exkretion UIE 
- Eisenkonzentration 
Magnetresonanz-Tomographie 
NTBI 
Quantitative Phlebotomie 
(MRI-R2) 
Hepcidin 
Endokard-Biopsie 
Herz-Eisen (T2*, investigativ) 
Tab 1: Indirekte und direkte Parameter in der Diagnostik und Kontrolle der Eisenüberladung. 
Nicht-invasive quantitative Eisenmessungen haben in den letzten Jahren zunehmendes Interesse gefunden (1),
nachdem zwar mit molekular-biologischen Methoden die verschiedenen Formen der hereditären Hämochromatose
besser differenziert werden können, aber nun auch die große Variabilität der überschüssigen Eisenspeicherung
trotz gleicher Genetik bei Patienten sichtbar geworden ist. Durch die Entwicklung neuartiger Eisenchelatoren
(Deferipron, Deferasirox) für die Behandlung sekundärer Eisenüberladungen ist das Interesse für eine genaue
Therapiekontrolle zusätzlich angeregt worden (4). In den letzten Jahren ist die Entwicklung von nicht-invasiven
Eisenmessungen im Herzen vorangetrieben worden, weil das Risiko für eine Herzeisenüberladung als Ursache von
Herzinsuffizienz und Arrhythmien bei Patienten mit b-Thalassämie im Zuge der längeren Lebenserwartung dieser
Patienten immer größer wird (5).
Einen zusätzlichen Stimulus erhielt diese Entwicklung durch Fortschritte in der Messtechnik. Die Lebereisen-
Suszeptometrie mit SQUID-Biomagnetometern steht als Routine-Methode an verschiedenen Zentren der Welt zur
Verfügung (New York, Hamburg, Turin, Oakland, Sao Paulo). Neue hoch-Temperatur basierte Systeme, die weniger
technische Expertise erfordern, befinden sich in der Entwicklung und Testung (6). Fortschritte in der
Magnetresonanz-Tomographie (MRI-R2) erlauben heute, die Eisenverteilung in einem ganzen Querschnitt der
Leber zu erfassen (7). Insbesondere die Anwendung von MRI-GRE-Methoden (Gradient Recalled Echo) zur
Erfassung der relativ niedrigen Herzeisenkonzentration (T2*) haben neue Möglichkeiten in der Behandlung der
Transfusionssiderose eröffnet (8).
Indirekte Parameter
Serum-Ferritin als Überwachungsparameter
Trotz der Limitierungen der Serum-Ferritin-Messung (SF) zur Erfassung der Eisenspeicher bei Patienten mit
Eisenüberladung (9), hat dieser Parameter seine Berechtigung in der Kontrolle der Eisenspeicher. Assays zur
Bestimmung von SF sind weltweit verfügbar, gut standardisiert und aufgrund ihrer Kosteneffektivitat wiederholt in
kurzen Zeitabständen einsetzbar. Bei Abwesenheit von Störfaktoren wie Entzündungen, Vitamin C Mangel,
oxidativem Stress, Leberfunktionsstörungen, vermehrtem Zelluntergang, etc., wird SF proportional zur Größe der
zellulären Eisenspeicher im Plasma angetroffen. Allerdings ist der Zusammenhang zwischen SF und den
Eisenspeichern bei Eisenüberladungskrankheiten wie Thalassämie, Sichelzell-Anämie, hereditärer
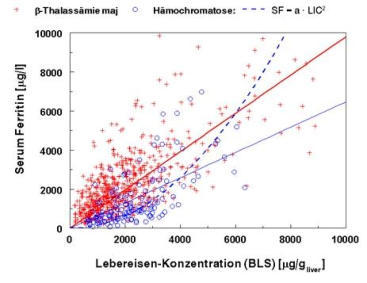
Hämochromatose oder anderen Hämoglobinopathien relativ komplex wie die Abb.1 zeigt.
Abb. 1: Serum-Ferritin (SF) und Lebereisenkonzentration (LIC) in Patienten mit b-Thalassaemia major (n = 626;
SF/LIC = 1.13, r2 = 0.59) und hereditärer Hämochromatose (n = 142; SF/LIC = 0.47, r2 = 0.35; quadratische
Funktion; SF/LIC2 = 1.6·10-4, r2 = 0.54). 
Die Korrelation zwischen Serum-Ferritin und Lebereisenkonzentration ist für Patienten mit b-Thalassaemia major
und hereditärer Hämochromatose zwar hoch-signifikant, aber als Prediktor für die Größe der Eisenspeicher ist SF
ungeeignet (Bestimmtheitsmaß r2: 59 % bzw. 54 %). Der nicht-lineare Zusammenhang für hereditäre
Hämochromatosen in Abbildung 1 zeigt die einsetzende Leberfibrose und die Auffüllung der RES-Eisenspeicher mit
zunehmender Eisenüberladung an. Darüber hinaus ist das Verhältnis SF/LIC für verschiedene Eisenüberladungs-
Krankheiten sehr unterschiedlich. Transfusionssiderosen besitzen im Plasma bei gleichen Eisenspeichern relativ
höhere Ferritinkonzentrationen als eisenladende Anämien (nicht transfundierte b-Thalassaemia intermedia) und
hereditäre Hämochromatosen (10). Dieses krankheits-spezifische Verhältnis SF/LIC sollte bei der semi-
quantitativen Einschätzung der Eisenspeicher Beachtung finden. 
Dennoch ist über einen kurzen Zeitraum (1-3 Jahre) bei bekanntem individuellen SF/LIC- Verhältnis das Serum-
Ferritin ein brauchbarer Verlaufsparameter für die Eisenspeicher solange die Transfusions- und Chelat-Behandlung
nicht geändert wird, die Compliance des Patienten gegeben ist und etwaige Störparameter wie Entzündungen (s.
o.) berücksichtigt werden. Die Messung der Eisenkonzentration im Serum-Ferritin, von der man anfangs annahm,
dass sie die Eisenspeicher ungestörter reflektieren würde, hat sich gegenüber der Messung des Serum- Ferritins
als nicht überlegen erwiesen (11).
Weitere indirekte Parameter (TfS, NTBI, Hepcidin)
Parameter wie Serum-Eisen oder Transferrin-Eisen-Sättigung (TfS) reagieren sehr empfindlich auf erhöhte
Eisenkonzentrationen im Blut, geben aber keine Information über den Grad der bestehenden Eisenüberladung. Sie
haben eine gewisse Berechtigung bei der Diagnostik der hereditären Hämochromatose (Screening-Parameter: TfS
> 52%) bzw. bei der Überwachung der Aderlass-Therapie (Monitor-Parameter: 20 < Tfs < 52%) (12). Bei Patienten
mit sekundären Siderosen sind sie meist ständig oberhalb der Norm und deshalb diagnostisch eher wertlos.
Früher wurde häufig der Desferal-Urineisen-Exkretionstest zur Bestimmung des Speichereisens eingesetzt, ohne
dass er einer kritischen Überprüfung standhielt. Im Hinblick auf die toxische Wirkung von Eisen könnte dieser Test
neues Interesse finden (13).
In Studien wird häufig das nicht-Transferrin-gebundene Eisen im Serum (NTBI) bestimmt, dem eine große Rolle als
katalytisch aktive Eisenform in der Pathogenese der Eisenüberladung zugeschrieben wird. Neuerdings kann auch
daraus eine evtl. biologisch aktive Unterfraktion (LPI, labile plasma iron) bestimmt werden. NTBI tritt bei
verschiedenen Eisenüberladungserkrankungen, aber auch bei anderen Krankheiten (z.B. Krebsleiden, Z.n.
Chemotherapie) auf, immer wenn im Blut die Transferrin-Eisen-Sättigung > 50% erhöht ist. Ein Zusammenhang mit
Gesamtspeichereisen besteht offenbar nicht, deswegen hat sich dieser Parameter in der Routinediagnostik nicht
durchgesetzt. 
Hepcidin spielt offenbar eine zentrale Rolle in der Regulation des Eisenstoffwechsels, speziell der intestinalen
Eisenabsorption. Eine Bestimmung von Hepcidin in Urinproben ist zuverlässig möglich. Es bleibt abzuwarten, ob
dieser Parameter diagnostisch bei Patienten mit primärer oder sekundärer Eisenüberladung zukünftig eine Rolle
spielen wird.
Direkte Parameter
Lebereisenquantifizierung
Bei Patienten mit sekundärer Eisenüberladung werden 70 – 90 % des Gesamtspeichereisens in den Hepatozyten
und Kupfferzellen der Leber gespeichert, hauptsächlich als Ferritin- und Hämosiderin-Eisen (9, 15). Effekte einer
Eisenentzugstherapie mittels Chelatoren oder Aderlässen werden am stärksten in der Leber angezeigt. Die
Bestimmung der Eisenkonzentration in der Leber erfolgt entweder invasiv durch Leberpunktion oder nicht-invasiv
durch die Ausnutzung der paramagnetischen Eigenschaften des Speichereisens. Andere nicht-invasive Methoden,
die die höhere Elektronendichte der Eisenatome (Z = 26) ausgenutzt haben wie die Röntgen-Computer-
Tomographie (16, 17) oder die die Kernenergieniveaus des Eisen-Isotops 56Fe angeregt haben wie die Kern-
Resonanz-Streuung (18), konnten sich bisher nicht durchgesetzen. Mit Ausnahme der Kern-Resonanz-Streuung
sind all diese Methoden nicht- spezifisch für Eisen. 
Sowohl die Magnetresonanz-Tomographie (MRI) als auch die Biomagnetische Leber-Suszeptometrie (BLS)
basieren auf den paramagnetischen Eigenschaften des Speichereisens, und für beide gelten die gleichen
physikalischen (magnetisches Dipolmoment) und mathematischen Grundkonzepte. Die magnetischen
Dipolmomente, sowohl die der Protonen bei MRI bzw. die der Eisenatome (Ferritin, Hämosiderin) bei BLS, erfahren
in einem angelegten Magnetfeld eine Ausrichtung, die durch thermische Bewegung gestört wird, sodass nur eine
kleine feldinduzierte Fraktion von Dipolmomenten letztlich das für die Diagnostik nutzbare Signal erzeugt. Die
Summe aller magnetischen Dipolmomente Smi in einem Volumenelement dV erzeugt die Magnetisierung M, wobei
diese für dia- und paramagnetische Materie (biologisches Gewebe) proportional dessen magnetischer
Suszeptibiltät (Materialkonstante) c und dem externen Magnetfeld Bf ist (Gleichung 4.1). 
(1)
Smi / dV = M ~ c Bf
(magnetische Suszeptibilität)
Die Änderung des magnetischen Flusses DF wird in einer Detektorspule, die in einem Volumenelement dV ein
virtuelles Magnetfeld Bd erzeugt, entweder als Radiowellen-Signal (MRI) bzw. als Spannungsänderung (BLS)
angezeigt (19). 
(2)
DF = ∫ M(r)•Bd dV 
(magnetisches Flussintegral für MRI und BLS)
Quantitative Eisenbestimmung mittels Leberbiopsie 
Seit der Durchführung der ersten Leberbiopsie durch Paul Ehrlich (1883), der massenhaften Anwendung während
und nach dem 2. Weltkrieg im Zusammenhang mit Hepatitis-Infektionen, haben verschiedene Leberbiopsie-
Methoden Eingang in die klinische Routine gefunden (20). Die häufigsten Komplikationen sind Blutdruckabfall
aufgrund von Blutungen (21) und Schmerzen in ca. 30% der Patienten (22). 
Inwieweit die Messung der Eisenkonzentration in einer Leberbiopsie als Referenzmethode für die genaue und
repräsentative Bestimmung der Eisenspeicher gelten kann, ist ein immer wieder diskutiertes Problem. Es herrscht
jedoch Einigkeit darüber, dass ein Mindestgewicht von ca. 4 mg Feuchtgewicht bzw. 1 mg Trockengewicht für eine
quantitative Bestimmung nicht unterschritten werden sollte (23). Außerdem sollte die Eisenverteilung in der Leber
homogen sein, was bei Eisenüberladungskrankheiten nicht immer gegeben ist (24).
In eisenüberladenen Patienten ohne Lebererkrankung haben Barry und Sherlock (25) eine gute Übereinstimmung
(Variationskoeffizient VK = 7.1 %) zwischen zwei Leberbiopsien aus voneinander entfernten Leberregionen
erhalten, allerdings bei einem durchschnittlichen Trockengewicht von 10 mg. Unter heutigen Bedingungen wurde in
Patienten mit b-Thalassaemia major und Sichelzell-Anämie mit einer Bajonett-Biopsienadel (mittleres
Trockengewicht 0,94 mg) eine ebenso gute Übereinstimmung gefunden wie die Abbildung 2 zeigt (26), wobei
allerdings auch Unterschiede von bis zu 30% gefunden wurden.
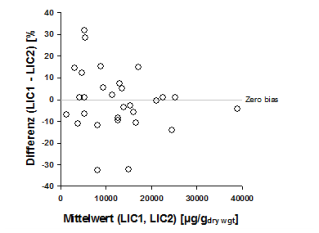
Abb. 2: Relative Abweichung der Eisenbestimmung (Altman-Bland Plot) zwischen 2 in Paraffin eingebetteten
Biopsien aus der gleichen Leberregion (VK 7.6 %) (34). 
Solange die Eisenbestimmung aus einer Leberbiopsie nur in einem Labor und mit der gleichen Biopsie-Technik
(Menghini, True-Cut, etc.) erfolgt, kann diese in vitro Methode abgesehen von Problemen der Eisenverteilung als
Referenz-Methode angesehen werden (26). Beim Vergleich mit in vivo Methoden, die LIC per se im nativen
feuchten Zustand messen und wie MRI meistens gegen LIC per Trockengewicht kalibriert werden, können
Unterschiede im Feucht-zu-Trockengewichts-Verhältnis für LIC-Variationen von im Mittel 20% hinzukommen. Der
lange Zeit unkritisch übernommene Konversionsfaktor von 3.33 für die Lebereisen-Konzentration und die daraus
abgeleiteten empfohlenen LIC-Bereiche (27) für die Therapie von Thalassämie-Patienten lassen sich so nicht
länger aufrechterhalten, wie eine neuere Untersuchung an Autopsie-Lebern (28) und schon frühere Studien gezeigt
haben (26, 29). Tabelle 2 zeigt für verschiedene Leberbiopsie-Prozeduren (Feuchtgewichts-Bestimmung,
Trockengewichts-Bestimmung, Paraffin-Block) die aktuellen Konversions-Faktoren und die sich daraus ergebenden
neuen Empfehlungs-Bereiche für die Lebereisen-Konzentration (29).
LIC (in vivo) LIC (70%) LIC (FT) LIC (PB) Kommentar 
(µg/gliver) (µmol/gliver) 
(mg/gdry w.) (mg/gdry w.) 
(mg/gdry w.) 
4.37 
5.83
120 °C Hitze getrocknet (28) 
Konversions-Faktor 3.33 
4.8 
6.4
LIC wet w. = 1.1 · LICin vivo 1000 
18 3.33 
4.5 ± 0.8 
5.5 ± 1.0 
Untere optimale Schwelle (27)
1300
23
4 
5.9 
7.2
max. LIC C282Y (+/-) (12) 
2100
38
7.0 
9.6 ± 1.7 11.7 ± 2.1 
Obere optimale Schwelle (27) 2884
52
10 
13.0
16.0
Fibrose Progression (30) 4500 
80
15.0
20.1 ± 3.6 24.6 ± 4.5 
Risiko f. Herzkrankheit (27) 
Tab. 2: Empfohlene optimale Lebereisen-Konzentrationen (LIC = 18 - 38 µmol/gwet weight) für die Behandlung von
transfundierten Thalassämie-Patienten (27). Konversionsfaktoren (28) beziehen sich auf in vivo LIC und sind für
LIC aus in Paraffin eingebetteten Biopsien (paraffin block PB) und aus Frisch-Gewebe (fresh tissue FT)
angegeben. Der weithin übernommene Feucht-zu-Trockengewichts-Faktor von 3.33 (27) basiert auf dem
Wassergehalt von 70% der normalen Autopsie-Leber und stellt einen unteren Wert dar.











Diagnostik bei Eisenüberladung
Die diagnostische Abklärung einer Eisenüberladung
geschieht in der Praxis häufig allein durch Messung der
bekannten Blutparameter (Serum-Eisen, Transferrin-Fe-
Sättigung und Serum-Ferritin). Diese indirekten
Parameter erlauben aber keine (Serum-Eisen) bzw eine
nur ungenaue Abschätzung (Serum-Ferritin) der
individuell vorliegenden Schweregrades der
Eisenüberladung. Neben der Art der betroffenen Zellen
(parenchymale oder makrophageale Eisenspeicherung)
ist aber gerade die Größe der Eisenspeicher ein
bestimmender Parameter für das klinische Ergebnis bei
systemischen Eisenüberladungen, unabhängig davon ob
sie durch Bluttransfusionen (wie bei Thalassaemia
major, Sichelzell-Anämie, aplastischer oder refraktärer
Anämie oder myelodysplastischem Syndrom) oder durch
hochregulierte Nahrungseisenabsorption (hereditäre
Hämochromatose, Thalassaemia intermedia, „iron-
loading-anemias“) verursacht werden.

Eisenüberladung
Aderlasstherapie. Methode aus dem Mittelalter!? Für Eisenspeicherkrankheit aber hochmodern





© www.eiseninfo.de