Eisenchelatoren in der Chemie und Industrie sind meist kleine Moleküle, die Eisen sehr fest binden. Allgemein
gilt, dass Chelatoren mit Sauerstoffliganden Fe3+ stabilisieren, während Liganden mit N- oder S-Atomen
vorzugsweise Fe2+ stabilisieren. Auf diese Weise greifen Liganden in den Redoxzyklus zwischen Fe2+ und
Fe3+ ein (Abb. 5.3). Liganden, die sowohl Fe2+ als auch Fe3+ binden, können den Redoxzyklus stimulieren.
Harte Liganden haben dagegen eine hohe Affinität für Fe3+ und verhindern dadurch eine Reduktion zu Fe2+ in
biologischen Systemen. Die meisten Eisenchelatoren sind gerade wegen ihrer Metallbindungsfähigkeit
hochgiftig und können klinisch nicht eingesetzt werden.
Eisenchelatoren können klassifiziert werden nach Ihrem Ursprung (synthetische oder biologische), nach der
Interaktion mit Wasser (hydrophil oder lipophil) oder ihrer stoichiometrischen Bindung mit dem Eisenatom
(zweizähnig bis sechszähnig).
Grundsätzliches Ziel der Verwendung von pharmazeutischen Eisenchelatoren bei
Eisenüberladungserkrankungen ist es a) reaktives freies Eisen zu „neutralisieren“ und b) überschüssiges
Speichereisen zu entfernen um insgesamt eiseninduzierte Zellschäden zu verhindern. Außerdem wird der
antineoplastische Effekt von Eisenchelatoren z.B. beim Neuroblastom und bei Hirntumoren untersucht. (15, 16).
Bisher haben nur wenige Chelatoren Einzug in die Therapie der Eisenüberladung beim Menschen gefunden.
Das Anforderungsprofil an einen idealen Eisen-Chelator ergibt sich aus der klinischen Anforderung:
•
orale Anwendbarkeit
•
gute Gewebepenetration
•
leichte Mobilisierbarkeit des Eisen-Chelatorkomplexes
•
möglich geringe Toxizität, möglichst hohe therapeutische Breite
•
möglichst niedriger Preis für eine evtl. lebenslangen Therapie
Dies ist allerdings leichter gesagt als getan, denn die Wirksamkeit von Eisenchelatoren ist insgesamt begrenzt,
die therapeutische Breite der bekannten Eisenchelatoren ist nicht sehr hoch und die Wirksamkeit ist
unterschiedlich für verschiedene Gewebe. Das Erreichen von sicheren Eisenkonzentrationen ist daher nur über
Monate oder Jahre einer gut angepassten und vom Patienten auch zuverlässig durchgeführten Therapie
möglich, wobei nicht gut definiert ist, was auf lange Sicht „sichere Eisenkonzentrationen“ eigentlich sind. Klar
ist, dass es für die wichtigen Organe Blut, Leber, Herz unterschiedliche kritische bzw. „sichere”
Eisenkonzentrationen gibt. Im Blut zirkulieren relativ gesehen nur geringe Eisenmassen (20-30 mg/Tag). Bei
Eisenüberladung ist sehr schnell die Bindungskapazität von Transferrin überschritten und es kommt zur Bildung
von nicht-Transferrin-gebundenem Eisen (NTBI) das in der Pathophysiologie der Eisenschädigung bei
Eisenüberladung eine besondere Bedeutung zukommt. In der Leber befindet sich ein großer Anteil des
überschüssig gespeicherten Eisens, bei Patienten mit ß-Thalassämie mehr als 80 %. Daher ist das Lebereisen
ein Hauptangriffspunkt der Eisenchelatortherapie. Herzversagen ist häufig die lebensbegrenzende Komplikation
bei Patienten mit ß-Thalassämie, wobei die Mengen an Speichereisen im Herzen auch in schweren Fällen nur
ein Bruchteil des Lebereisens ausmacht. Offenbar gehören aber Zellen des Herzen zu den empfindlichsten
Zellen überhaupt, was eine Schädigung durch Eisen angeht. Individuell besteht keine gute Korrelation
zwischen Eisenspeicherung in der Leber und im Herzen. Um eine negative Eisenbilanz bei einem chronisch
transfundierten Patienten zu erreichen müssen mehr als 0.4-0.5 mg Fe/kg täglich entfernt werden können.
Eisenchelatoren müssen mit zwei prinzipiellen Eisenkompartimenten wechselwirken: dem intrazellulären
Eisenpool, z.B. von Hepatozyten, in dem ein Großteil des überschüssigen Speichereisens abgelagert ist und
dem Eisenpool im Monozyten/Makrophagen-System, die mit dem Abbau von Erythrozyten beschäftigt sind.
Hierbei zeigen sich große Unterschiede zwischen verschiedenen Eisenchelatoren und es resultieren
unterschiedliche Ausscheidungswege für cheliertes Eisen über die Galle oder über die Nieren.
Siderophoren
Von Siderophoren abgeleitet sind Deferoxamin (DFO), Desferrithiocin (DFT) und Desferri-exochelin (D-Exo).
DFO ist z.Zt. die erste Wahl bei der Behandlung von sekundären Hämosiderosen und wird ausführlich in Kapitel
6 behandelt.
DFT ist ein dreizähniger Ligand für Fe 3+ aus dem Bakterium Streptomyces antibioticus DSM 1865. Es ist oral
wirksam und kann im Tiermodell überschüssiges Eisen mobilisieren (18).
Es zeigt leider eine schwere Nephrotoxizität was auf den cytotoxischen Effekt von (DFT)2:Fe zurückgeführt
wird. Es wurde eine ganze Reihe von Derivaten synthetisiert, um besser verträglichere Varianten zu entwickeln.
Im Tierversuch erfolgreich und wenig toxisch ist das Derivat 4-Hydroxy-desazadesferrithiocin (19). Versuche
am Menschen wurden bisher nicht durchgeführt.
D-exo gehört zu einer Gruppe von sechszähnigen Siderophoren aus Mycobakterium tuberculosis, die sowohl
lipophile als auch hydrophile Eigenschaften hat, was eine gute Zellpermeabiliät verspricht. In-vitro Versuche
zeigen eine Eisenmobiliserungkapazität aus Ferritinproben.
Synthetische Eisenchelatoren
Zu den synthetischen Eisenchelatoren gehören die Hydroxypyridinone mit Deferipron (DFP) als
Hauptverbindung (s. Kap. 8), die 1,2,4-Triazole mit ICL670 als klinisch neu eingeführtes Medikament, die
Tachypyrine, Aroylhyrazone und die Thiosemicarbazone (20, 21).
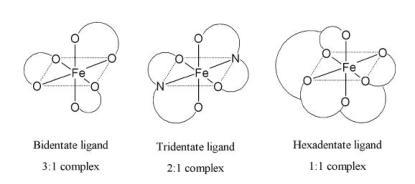
Grundsätzlich kann bei den Chelatormolekülen die Anzahl der in einem Molekül vorhandenen Sauerstoff- oder
Stickstoffatome variieren, die an der Komplexbindung mit Eisen beteiligt sind. Es resultieren 2,3- oder 6-
zähnige Eisenchelatoren (Abb. 5.4.)
Abb. 2 Verschiedene Koordination von Komplexen zwischen Liganden und Eisen bei
Eisenchelatoren













© www.eiseninfo.de
Eisenchelatoren
Bei Patienten mit sekundären Siderose infolge einer
„Iron-loading anaemia“ oder einer reinen
Transfusionssiderose kann man in der Regel keine
einfache Aderlasstherapie durchführen. In Fällen mit
einer leichten Anämie bestätigen Ausnahmen die Regel
(12). Bei den typischen Patienten können aber
ausschließlich nur eisenbindende Substanzen zur
Eisenentzugstherapie herangezogen werden.
Ein Chelator (aus dem Griechischen χηλή, chelè, Kralle
Schere) bindet als Ligand reversibel an ein Metallion.
Im Falle von Eisen können biologische oder
synthetische Chelatoren die Eigenschaften des
Metallions besonders stark verändern, denn der leichte
Wechsel der Oxidationsstufe, des
Reduktionspotentials, der Koordinationszahl, des
Elektronenspins, des Ligandentyps, -gleichgewichts
und -dynamik zeichnet Eisen in biologischen Systemen
in besonderem Maße aus.
Biologische eisenbindende Liganden, Siderophore,
sind weit verbreitet und dienen z.B. Bakterien zur
Bioverfügbarmachung des essentiellen
Spurenelementes (13).
Abb. 1: Einfaches Modell eines „zweizähnigen“
Eisenchelators
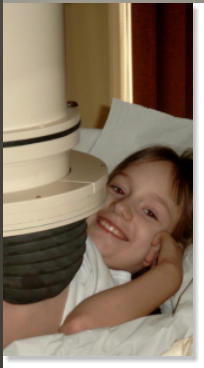
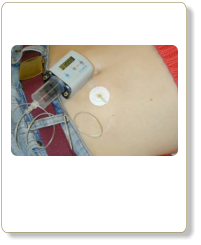
Eisenchelatortherapie
Subkutane Therapie mit Desferal mit einer kleinen Pumpe meist über Nacht.