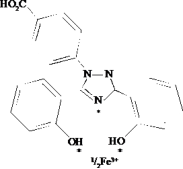
Abb. 1.: Struktur von Deferasirox (DSX) mit seinen drei Bindungsstellen für Eisen. 2 Moleküle DSX binden ein Atom
Fe(III). Der 2:1 Komplex mit Fe(III) ist nach außen hin negativ geladen. 
DSX ist ein achiraler, dreizähniger Ligand für Fe3+. Zwei Moleküle von Deferasirox können einen Komplex mit Eisen
bilden (Abb. 1). Neben den „harten“ Sauerstoffatomen sind auch zwei „weiche“ N-Atome an der Fe(III)-Bindung
beteiligt, was nach R.C.Hider theoretisch zu einer geringeren Metallionen-Selektivität führen könnte (2). 
Im Vergleich zu DFO ist die Affinität für Eisen beurteilt am pM-Wert geringer, aber deutlich höher als von DFP (3). In
Ratten und Marmoset-Affen wird 14C-markiertes DSX (10 und 25 mg/kg oral) rasch und vollständig (75 %)
absorbiert. Maximale Plasmaspiegel traten nach 0.5 h auf. Die Plasmahalbwertszeit beim Menschen beträgt 11-19
Stdn. Die absolute Bioverfügbarkeit, verglichen mit einer i.v.-Dosis, betrug in beiden Spezies 30-40 %, in Hunden 80-
100 % (1). 
Im Fall von Deferasirox ist das geladene Chelat (Fe-[ICL670]2-) deutlich hydrophiler als der Chelator (4). Dies hat
aber wenig Einfluss auf die Proteinbindung. Im Blut von verschiedenen Spezies, inkl. des Menschen, sind
Deferasirox und sein Eisenchelat fast ausschließlich im Plasma zu finden, fest gebunden an Plasmaproteinen wie
z.B. Albumin (5). Der ungebundene Anteil im Plasma liegt jeweils unter 2 %. Bei hohen Dosen verdrängt Deferasirox 
Markermoleküle vom Albumin. Ein daraus theoretisch abgeleitetes Risiko einer Wechselwirkung mit anderen,
ebenfalls proteingebundenen Medikamenten wird aber als gering eingestuft (5).
Präklinische Studien 
Erste in vivo Versuche wurden mit Gallengangs-kanülisierten Ratten durchgeführt und dabei nach oraler
Einmalgabe die 24h-Ausscheidung in Galle und Urin gemessen (1). Es resultierte eine relativ langandauernde
Eisenausscheidung, die mit 18 % der berechneten Menge sehr effizient war. DSX gehört damit bei diesem Modell zu
den effizientesten Eisenchelatoren, die jemals getestet wurden (DFO 3-4 %, DFP 2 %). Weitere Untersuchungen
wurden in eisenüberladenen Ratten (TMH-Ferrozenmodell) durchgeführt In einer Therapie-Studie wurde die
Wirksamkeit von DSX (75µMol/kg/Tag = 56 mg/kg/Tag) mit DFO und DFP (jeweils 150 µMol/kg/Tag) verglichen. Die
Abnahme der Lebereisenkonzentration war mit DSX (60% Reduktion) doppelt so groß wie mit DFO (60 % bei
zweifach höherer Dosis) und viel effizienter als mit DFP (29 % Reduktion bei doppelter Dosis). Das in diesem
Tiermodel akkumulierte Eisen in Nieren wurde mit DSX sehr rasch vollständig abgebaut, sogar auf Werte unterhalb
von Kontrolltieren. Es wird diskutiert, ob diese Induktion von Eisenmangel im Nierengewebe bei Ratten als Ursache
für die beobachtete Nierentoxizität von DSX in Betracht kommt. In einem Tiermodell mit selektiver
Radioeisenmarkierung von hepatozellulären (59Fe-Ferritin) und mononuclear-phagozytären (MP) Eisenspeichern
(59Fe-markierte Hitze-geschädigte-Erythrozyten) zeigen DFO und DSX Wirksamkeit auf den Abbau von beiden
Eisenspeichern, wobei der Weg der Entspeicherung unterschiedlich war (6). Nach i.v.-Injektion des Chelators wurde
DFO gebundenes Radioeisen aus MP-Speichern vorwiegend im Urin, hepatozelluläres Eisen vorwiegend im Stuhl
gefunden. Mit DSX cheliertes Eisen erscheint dagegen immer im Stuhl, egal ob es aus MP- oder aus hepatozytären
Speichern stammt.
Studien an Primaten wurden zuerst an Marmoset-Affen durchgeführt, die durch i.p. Injektion von Eisendextran
eisenbeladen wurden. In einer dosisabhängigen Wirksamkeit (14-112 mg/kg) wurde nach DSX-Gabe Eisen ganz
überwiegend im Stuhl ausgeschieden.
Eine effektive Dosis, die 500 µg Fe/kg/Tag ausscheiden lässt, was eine notwendige Zielgröße bei Thalassämie-
Patienten unter chronischer Transfusionstherapie darstellt, wurde mit 22 mg/kg/Tag DSX erreicht. An dieser Dosis
hat man anfangs die Dosierung bei den Zulassungsstudien am Menschen orientiert. Die in-vivo-Effektivität von
DSX, definiert als Menge an ausgeschiedenem Eisen in % der theoretischen Menge an Chelator war 29 % bei einer
Dosis von 150µMol Eisenbindungskapazität/kg. Im Vergleich dazu zeigte sowohl DFP als auch DFO mit 2 bzw. 3 %
eine deutlich niedrigere Effektivität. 
Toxikologie in Tiermodellen 
Ähnlich wie bei DFO ist die Häufigkeit und Schwere der Nebenwirkungen bei DSX im Tierversuch abhängig vom
Grad der bestehenden Eisenüberladung. Die Erzeugung von schwerem Eisenmangel in Geweben wird als eine
wichtige Ursache für toxische Reaktionen von DSX angesehen. Das gilt offenbar insbesondere für die beobachtete
Nephrotoxizität von DSX in Tiermodellen (1). Toxizitätsuntersuchungen wurden in Ratten bis 26 Wochen und bei
Marmoset-Affen bis 39 Wochen durchgeführt. Bei Ratten ergab sich eine Kein-Effekt-Dosis von 30 mg/kg/Tag.
Männliche Ratten reagierten empfindlicher auf DSX, was parallel mit niedrigeren Gewebeeisenkonzentration lief. Die
Mortalität in Ratten war an eine renale Toxizität geknüpft. Eine okulare Schädigung in Form von Kataraktbildung war
dosisabhängig, wobei eine Schädigung bei der höchsten Dosis (180 mg/kg) früher auftrat. Eine ähnliche Schädigung
ist von DFO bekannt. 
Bei Marmosets wurden nach Abschluss der Studie histologisch keine Schädigungen festgestellt, auch keine
kataraktähnlichen Veränderungen. 
Phase III-Studien 
Eine vergleichende Multizentren-Studie zur Wirksamkeit von DSX wurde in regelmäßig transfundierten Patienten mit
b-Thalassämie durchgeführt (12). Eingeschlossen wurden eisenüberladene Patienten älter als 2 Jahre mit einer
Lebereisaenkonzentration > 2 mg Fe/g Tr.Gew.). Während einer Therapiedauer von 12 Monaten erhielten 296
Patienten DSX, 290 Patienten DFO in einer Dosierung, die individuell anhand der initialen Leber-Eisenkonzentration
festgelegt wurde. Der primäre Endpunkt war das Konstanthalten bzw. die Reduktion des Lebereisens, sekundäre
Endpunkte waren Sicherheit und Tolerabilität, der Verlauf des Serum-Ferritins und die netto-Eisen-Bilanz. 
Bei der Untergruppe der schwer eisenüberladenen Patienten waren beide Chelatoren gleich gut wirksam, in ca. 59
% der Fälle blieb das Lebereisen stabil bzw. wurde im Therapiezeitraum abgesenkt
Insgesamt zeigte diese Studie, wie vorher nicht erwartet, eine Überlegenheit von DFO gegenüber DSX. Die Autoren
führen dies auf die Anwendung von zu niedrigen DSX -Dosen zurück (5 und 10 mg/kg/Tag). Im Detail bewirkte DSX
in einer Dosis von 20 mg/kg ein Stabilhalten, eine Dosis von 30 mg/kg führte zu einer Reduktion der
Lebereisenkonzentration. Dosen von 5 und 10 mg/kg waren zu gering für Thalassämie-Patienten, die regelmäßige
Bluttransfusionen erhielten In der Studie wurde die Lebereisenkonzentration (LIC) teilweise durch Eisenbestimmung
aus Biopsieproben (n = 224, bzw. 230) beurteilt, bei manchen Patienten wurde LIC auch nichtinvasiv mit der SQUID-
Technik (n = 44 bzw. 43) gemessen. Leider verwenden diese Methoden auch in dieser Studie unterschiedliche
Bezugspunkte (SQUID, mg Fe/g Feuchtgewicht; Biopsie und MRI, mg Fe/g Trockengewicht). 
Bei der Umrechnung von Feuchtgewicht in Trockengewicht wurde ein Faktor von 3.3 herangezogen und damit
festgestellt, dass die SQUID-Werte im Vergleich zur Biopsie offenbar systematisch zu niedrig liegen. Andere Studien
legen beim Menschen aber eher Umrechnungsfaktoren von 5 - 6 nahe. Da ein solcher Umrechnungsfaktor kritisch
ist, wäre im Verlauf von weiteren Studien anzuraten, in einem System zu bleiben, entweder bei Patienten
durchgehend invasive Biopsien oder eine nichtinvasive Methode (SQUID, MRI) einzusetzen, sodass dieses Problem
erst gar nicht auftritt (13). 
Der Verlauf der Serum-Ferritinwerte zeigt ebenfalls einen Unterschied zwischen DSX und DFO (Abb. 4). 
Bei der Dosis von 20 mg/kg DSX ergab sich ein stabiles, bei der Dosis von 30 mg/kg ergab sich im Mittel ein Abfall
des Serum-Ferritins im Laufe der Studie. Bei einer linearen Regression, ergab sich die bekannt schwache
Korrelation zwischen individuellen LIC und Serum-Ferritin (r = 0.63). 
Als häufigste Nebenwirkungen wurden in dieser großen Studie ein Hautauschlag, gastrointestinale Beschwerden
und milde, nicht-progressive Erhöhungen vom Serum-Kreatinin-Wert festgestellt. Eine Agranulozytose, Arthropathie
oder Wachstumsstörungen wurden nicht beobachtet.
Die Autoren dieser Studie halten Deferasirox für einen hoffnungsvollen Eisenchelator mit einmal-Dosis-Charakter in
der Behandlung von transfusionsbedingter Eisenüberladung.
Ausblick
Seit der Zulassung von Deferasirox für die Therapie von Transfusionssiderosen sind weltweit sehr viele Patienten mit
diesem oralen Eisenchelator behandelt worden und es hat sich dadurch z.B. die Therapie von Thalassämiepatienten
verbessert. Es werden dabei meist Dosen von 10- 40 mg/kg/Tag eingesetzt mit einer Einzeldosierung morgens
(Herstellerempfehlung), oder auch einer geteilten Dosis morgens und abends (Zentren abhängig, z.B. Kinderklinik
UKE, Hamburg). 
Was z.Zt. noch aussteht sind Langzeitergebnisse von Patienten, so wie sie es von Deferoxamine gibt. Außerdem ist
die Wirkung von Deferasirox auf eine potentielle gefährliche Herzeisenüberladung noch nicht abschließend geklärt. 











© www.eiseninfo.de
Therapie mit Deferasirox
Deferasirox (DSX, ICL670, ExjadeTM) ist ein neuer
oraler Eisenchelator, der von der Fa. Novartis
entwickelt und vor kurzem in der Schweiz und in
USA/Kanada (FDA approval: Nov 2005) zugelassen
wurde. In einer umfangreichen Suche unter 750
Chelatoren aus unterschiedlichen chemischen
Substanzklassen wurden auch die Eigenschaften von
bis-(Hydroxyphenyl)-Triazolen untersucht (1). Mit
Hilfe von komplexen Modellrechnungen wurden
Triazole als ideale Linker zwischen einem N-Atom
und zwei phenolischen Sauerstoffatomen erkannt
und mehr als 40 Triazolderivate synthetisiert. In
Studien bezüglich Wirksamkeit und Tolerabilität an
Ratten und an Marmoset-Affen wurde DSX als
erfolgversprechenster Kandidat ausgewählt.
Deferasirox (DSX, ICL670, ExjadeTM) ist ein neuer
oraler Eisenchelator, der von der Fa. Novartis
entwickelt und vor kurzem in der Schweiz und in
USA/Kanada (FDA approval: Nov 2005) zugelassen
wurde. In einer umfangreichen Suche unter 750
Chelatoren aus unterschiedlichen chemischen
Substanzklassen wurden auch die Eigenschaften von
bis-(Hydroxyphenyl)-Triazolen untersucht (1). Mit
Hilfe von komplexen Modellrechnungen wurden
Triazole als ideale Linker zwischen einem N-Atom
und zwei phenolischen Sauerstoffatomen erkannt
und mehr als 40 Triazolderivate synthetisiert. In
Studien bezüglich Wirksamkeit und Tolerabilität an
Ratten und an Marmoset-Affen wurde DSX als
erfolgversprechenster Kandidat ausgewählt. 
Eisenchelatortherapie
Deferasirox, der neue orale Eisenchelator