



Ferritin besteht aus einem Kern von Eisenoxid-Hydroxid-Phosphat-Komplex ([FeO(OH)]8[FeO(H2PO4)]), der von
einer Hohlkugel aus 24 Untereinheiten (H- und L-Apoferritin) umhüllt wird (5). Ein Ferritinmolekül kann bis zu 4500
Eisenatome speichern (MW bis zu 900.000 Dalton). Der Eisentransport erfolgt über definierte Kanäle der
Proteinhülle. Isoferritine unterscheiden sich in der Zusammensetzung ihres Hüllproteins. Basische (mehr L-
Untereinheiten) kommen in Leber, Milz und Knochenmark vor. Saure H-Typ-Ferritine sind eisenärmer und kommen
vorwiegend im Herz, in der Plazenta aber auch in Tumorzellen vor. Antikörper in den handelsüblichen Ferritinassays
erfassen beide Formen. Der Ursprung von Plasmaferritin ist nicht ganz klar. Die Eisenspeicher befinden sich
Knochenmark, Muskulatur und Leber im Makrophagen/Monozytensytem und in Hepatozyten, Makrophagen und
Ferritin korreliert mit diesen Speichern, sodass man davon ausgeht, dass diese Zellen physiologischerweise
glykosyliertes Ferritin ins Plasma sekretieren (6).
Nachdem Ferritin als intrazelluläres Protein seit Jahrzehnten bekannt war, galt bis in die 70-iger Jahre, dass Ferritin
nur unter pathologischen Bedingungen im Serum nachweisbar sei (7). 1972 wurde erstmals ein empfindlicher
Radioimmunoassay entwickelt, mit dem Ferritin im Serum nachzuweisen war (8). Es wurde in der Folgezeit schnell
deutlich, dass dem Serum-Ferritin eine große diagnostische Bedeutung zukommt (9, 10). Obwohl die
physiologische Funktion von Ferritin im Plasma unklar ist, so liefert die Ferritinbestimmung eine semiquantitative
Aussage über den Füllungsgrad von Eisenspeichern sowohl bei Eisenmangel als auch bei Eisenüberladung. Serum-
Ferritin zeigt keine Tag-zu-Tag-Variation und es gibt wohl keine falsch erniedrigten Werte, d.h. ein niedriger Serum-
Ferritinwert beweist einen Eisenmangel. Die Ferritinbestimmung gilt als sehr zuverlässig, große Labore führen
regelmäßig Ringversuche durch, die sich an internationalen Standards orientieren.
Problematisch sind allerdings falsch erhöhte Ferritinwerte, die nicht mit den Eisenspeichern korrelieren. Ferritin ist
auch Teil des Akut-Phase-Systems, das empfindlich auf Gewebsverletzungen zum Beispiel bei Infekten, Tumoren,
reagiert. Insbesondere Leberschäden setzen häufig Ferritin aus Leberzellen frei, die in der Menge deutlich das
normale Plasmaferritin übertreffen und dann eine Eisenüberladung vortäuschen. Der Eisengehalt von Ferritin im
Plasma kann bestimmt werden. Entgegen anfänglichen Erwartungen ist dieser aufwendiger zu bestimmende
Parameter der einfachen Ferritinbestimmung nicht überlegen (11).
Serum-Eisen, Transferrin, Transferrin-Eisen-Sättigung 
Im Blut wird Eisen an Transferrin gebunden transportiert. Transferrin ist im Normalfall nur zu ca. 1/3 mit Eisen
gesättigt, wobei zwei Atome Eisen sehr fest (Kd= 10-23 M) an einem Molekül Transferrin binden (12). Seit der
Einführung der Serumeisen-Untersuchung 1937 sind zahlreiche Angaben über Normalwerte bei Männern und
Frauen erschienen (13). Die Bestimmung sollte immer morgens nüchtern erfolgen, eine gewisse Tag-zu-Tag
Variation ist vorhanden, sodass die Aussagekraft in Richtung Eisenmangel problematisch ist. Das Serum-Eisen ist
empfindlich gegen Eisenüberladung und spielt deshalb beim Screening auf hered. Hämochromatose eine einfache
und wichtige Rolle. Bei Infekten ist das Serum-Eisen häufig erniedrigt, was als Abwehrmehrmechanismus gegen
bakterielle Infektionen gesehen wird, da Bakterien auf die Eisenversorgung aus dem Plasma angewiesen sind.
Früher wurde zusätzlich häufig die Totale Eisenbindungskapazität gemessen, indem eine definierte Menge Eisen zu
Serum-Proben zugesetzt wurde und der nicht von Transferrin abgesättigte Anteil zurückgemessen wurde (14). Diese
Bestimmung ist heute weitgehend durch die direkte Bestimmung von Transferrin verdrängt worden. Transferrin ist
erhöht im schweren Eisenmangel und erniedrigt bei Eisenüberladung, beide Veränderungen dokumentieren den
Versuch der Gegenregulation des Körpers, um mehr bzw. weniger Eisen in Zellen aufzunehmen. Serum-Transferrin
hat einen Kohlenhydratanteil, der über Sialinsäurereste an Transferrin gebunden ist. „Karbodeficientes“ Transferrin
ist eines der besten diagnostischen Parameter für regelmäßigen starken Alkoholmissbrauch. Die Konzentration von
mono- und die disialo-Isoformen (üblicherweise 1%) steigen bei Alkoholismus zu Lasten der tetra oder hexa-
Isoformen stark an (auf 10 %) (15). 
Die Transferrin-Sättigung wird anhand des gemessenen Transferrin-Werts und des freien Eisens im Serum
errechnet. Die Transferrin-Sättigung ist ein sehr empfindliches Maß für die Menge an Eisen, die für die Erythropoese
und den zellulären Bedarf verfügbar ist. Bei chronisch entzündlichen Erkrankungen ist die Transferrin-Sättigung
meist im unteren Normbereich oder leicht reduziert. 
Löslicher Transferrin-Rezeptor 
Der lösliche Transferrin-Rezeptor ist ein Teilstück des normalen Oberflachenrezeptors und kann durch Proteolyse
als lösliche Form ins Blut freigesetzt werden. Dieser als „Shedding“ bezeichnete, offenbar physiologische Prozess,
ist für viele Proteine unterschiedlichster Struktur und Eigenschaften beschrieben, dazu gehören Rezeptoren,
Liganden, Zelladhäsionsmoleküle und Ektoenzyme (16). Die Zahl der TfR auf der Zelloberfläche reflektiert den
Eisenbedarf der betreffenden Zellen. Ein Eisenmangel führt zu einer Induktion der Transferrinrezeptorsynthese. Es
gibt eine Reihe von Studien, die die Messung des löslichen Transferrinrezeptors bei Patienten mit Eisenmangel und
Eisenüberladung als neuen quantitativen Eisenparameter favorisieren (17). Insbesondere bei Infekten soll die
Bestimmung weniger falsch veränderte Werte zeigen als das Serum-Ferritin. Der sogenannte Ferritinindex
(sTfR/logSerum-Ferritin) wird als gutes Maß für das Ganzkörpereisen angesehen (18) 
Zinkprotoporphyrin 
Ein Mangel von verfügbarem Eisen für die Erythropoese führt zu einem Einbau von Zink in den Protoporphyrin-
Komplex und damit zu einer Bildung von Zinkprotoporphyrin (ZPP) anstatt von Hämoglobin, was an der starken
Fluoreszenz von ZPP einfach uns kostengünstig bestimmt werden kann (19). 
Es konnte gezeigt werden, dass die Zinkprotoporphyrin-Werte eng mit dem Anteil hypochromer Erythrozyten bei
Patienten mit Eisenmangelanämie korrelieren (20). ZPP ist ein Meßparameter, der als Endpunktskontrolle der
Erythropoese angesehen werden kann, auch bei eisendefizitärer Erythropoese mit normwertigen oder nur gering
verminderten Eisenspeichern und Transportproteinen zeigen sich deutlich erhöhte Werte. Einschränkend gilt aber,
dass die ZPP-Messung bei Schwangeren, Kindern, Thalassämie-minor Patienten und bei renaler Anämie kein
empfindlicher Test auf Eisenmangel ist (20, 21).
Hämoglobin in Retikulozyten, Anteil hypochromer Erythrozyten 
Mit modernen Duchflußzytometern (z.B. Technikon H1-3) kann man die Retikulozyten oder Erythrozyten hinsichtlich
Größe und ihrem individuellen Hämoglobin-Gehalt erfassen (22). Da Retikulozyten nur ein bis zwei Tage zirkulieren,
reagiert der Anteil des Hämoglobins im Retikulozyten (CHr) zeitnah auf eine Einschränkung der Eisenversorgung,
während die üblichen Blutbildparameter (MCH, MCV) erst nach Wochen bis Monaten eine Veränderung anzeigen.
Bereits früh wurde auch erkannt, dass der Anteil der hypochromen Erythrozyten (%Hypo) ein sehr sensitiver Marker
für eine eisendefizitäre Erythropoese unter fortgesetzter Erythropoetin-Therapie ist. Die abnormal kleinen und
hämoglobinarmen maturen Erythrozyten reagieren im Vergleich zu CHr aber deutlich später (23). 
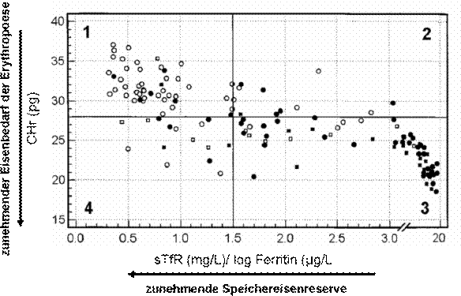
Von Thomas und Thomas stammt eine Auswertung von CRP, CHr und Ferritinindex (24,25). Gegenüber einer
alleinigen Ferritinbestimmung zeigt das 4-Felder-Diagramm nach Meinung der Autoren Vorteile in der Abklärung und
Verlaufsbeurteilung komplexer Eisenstoffwechselstörungen, insbesondere von funktionellem Eisenmangel bei
Patienten mit renaler Anämie (Abb. 3). Zudem können für einzelne Patienten therapeutische Empfehlungen
ausgesprochen und der Erfolg kontrolliert werden.
Abb. 3. 4-Felder-Diagramm nach Thomas und Thomas ( 25) von 154 Patienten mit Anämie ohne akute-Phase-
Reaktion (CRP<5). 1, ausreichende Eisenspeicher; 2, verminderte Speichereisenreserve bei noch nicht
vorhandenem funktionellen Eisenmangel; 3, Mikrozytäre, hypochrome Erythropoese aufgrund eines klassischen
Eisenmangels; 4, Funktioneller Eisenmangel bei normaler oder vermehrter Speichereisenreserve.
Diese „High-End“-Diagnostik von Eisenparametern bei Patienten ist aufwendig, kompliziert und kostenträchtig. Die
Ergebnisse und Aussagen sind etwas verwirrend und es ist für den normalen Patienten mit einfachem Eisenmangel
schwer zu erkennen, wo der diagnostische Vorteil liegt. Für Patienten mit komplexen Krankheiten und Therapien
(z.B. parenterale Eisentherapie begleitend zur Behandlung rHuEPO) und evtl. sekundär veränderten Serum-
Ferritinwerten könnte diese Art der Diagnostik aber nützlich sein. 
Hepcidin/BMP6 
So wie bei Diabetes mellitus das Hormon Insulin gemessen werden kann und dadurch wichtige Informationen über
die Insulinsynthese und Insulinresistenz erhalten werden, so kann man bei Eisenmangel theoretisch das
Eisenhormon Hepcidin im Urin oder Serum bestimmen. Experimentell gibt es dazu bei Patienten mit
unterschiedlichen Erkrankungen, inkl. Eisenmangelanämie und Anämie bei chronischer Erkrankung, bereits
zahlreiche Befunde (26, 27). Ein großes Problem ist die reproduzierbare Analyse von Hepcidin, für das es bisher
keinen allgemein verfügbaren, weltweit akzeptierten immunologischen Test gibt (28). Grund ist Schwierigkeit,
optimale Antikörper gegen dieses kleine (25 AS) und hochkonservierte Peptid herzustellen. Bisher scheinen
Methoden am zuverlässigsten zu sein, die Hepcidin säulenchromatographisch reinigen und dann mittels
Massenspektroskopie bestimmen (29). Wegen dieser technischen Probleme gibt es von Patienten mit
verschiedenen Krankheiten nur wenige Daten, teilweise nur Einzelbefunde. Es ist aber absehbar, dass die
Hepcidinbestimmung zukünftig diagnostisch wertvoll sein könnte. Mögliche Anwendungsfelder könnten sein: das
Erkennen einer Eisenmangelkomponente bei Patienten mit Anämie bei chronischer Erkrankung, Screening und
Verlaufkontrolle von hereditärer Hämochromatose, Abschätzung der Eisenüberladung und der erythrpoetischen
Aktivität von „iron-loading anemias, Therapiekontrolle der EPO-Medikation bei renaler Anämie. 
BMP6 ist aktuell gerade als wichtiger Aktivator der HJV/BMP-Kaskade erkannt worden. Möglich erscheint, dass
dieser Parameter einfacher und zuverlässiger zu messen sein wird, und dabei ähnliche interessante Aussagen wie
die Hepcidinbestimmung liefern könnte.
Referenzmethoden
Als Referenzmethoden für die Untersuchung des individuellen Eisenstatus gelten unverändert die histologische
Beurteilung von Knochenmarksausstrichen nach Berliner Blau-Färbung und die Messung der intestinalen 59Fe-
Absorption nach oraler Gabe von analytischen (10 µMol) oder therapeutischen (100 mg) Eisendosen (30-32). Die
Knochenmarkbiopsie ist naturgemäß invasiv und schmerzhaft, die Verwendung von radioaktivem Eisen beinhaltet
eine (kleine) Strahlenbelastung für den Patienten und setzt das Vorhandensein von Spezialgeräten voraus. Beide
Referenzmethoden werden deshalb nur noch begrenzt eingesetzt, sie liefern aber im Einzelfall immer noch
wertvolle Informationen. 
Eisen im Knochenmarksausstrich 
Die licht- und elektronmikroskopische Beurteilung von nicht-Häm-Eisen im Knochenmarkzellen ermöglicht die
Beurteilung von Störungen des Eisenstoffwechsels. Physiologischerweise findet sich Speichereisen in
Knochenmarkmakrophagen in Form von freien Ferritinmolekülen im Cytoplasma (Berliner-Blau-Reaktion: diffuses
Eisen (normal 1+ bis 4+) oder in Form von aggregiertem Ferritin oder Hämosiderin in Siderosomen (scholliges
Eisen, normal + bis 3+) (30, 31). Im Zuge der Erschöpfung der Eisenreserven wird immer weniger diffuses oder
scholliges Eisen nachweisbar, ein substantieller Eisenmangel ist also am fehlenden Speichereisen zu erkennen.
Diese Technik ist spezifisch auf Eisenmangel, Störungen durch Infekt etc. wirken sich nicht störend aus, die
Abgrenzung zwischen Eisenmangelanämie und einer ebenfalls hypochromen, mikrozytären Anämie bei 
Thalassämie ist möglich.
Untersuchung mit 59Fe 
Unter Verwendung eines empfindlichen Großraumradioaktivitätsdetektors mit 4 pgr-Meßgeometrie kann die
intestinale Absorption von 59Fe aus einer diagnostischen Dosis von 10 µMol (=0.56 mg) 59Fe2+ gemessen werden
(30). Absorbiertes Eisen hat eine sehr lange biologische Halbwertszeit (Frauen, 1575 Tage; Männer 2229 Tage),
sodass die Ganzkörperretention nach 10-14 Tagen ein gutes Maß für Eisen-Absorption dargestellt. Die 59Fe-
Absorption und die 59Fe-Erythozyteninkorporation nach > 10 Tagen lassen eine Malabsorption bzw. eine
Malutilisation von Eisen bei bestimmten Krankheiten erkennen (Eisenmalabsorption bei Zottenatrophie,
Eisenmalutilisation bei Entzündung/Infekt). Mit der absorbierten 59Fe-Dosis, die sich bei Patienten mit
Eisenmangelanämie nach > 10 Tagen vollständig im Hämoglobin zirkulierender Erythrozyten befindet, kann man
sehr präzise Blutverluste quantifizieren und auf dieser Weise z.B. Hypermenorrhoen von gastrointestinalen
Blutverlusten unterscheiden. 

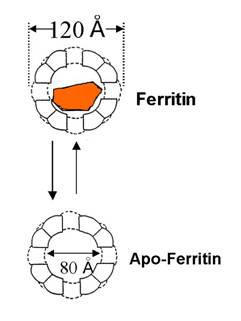
Abb. 1. Struktur des Ferritins. H und L-
Untereinheiten formen eine Hülle, in der bis
4500 Eisenatome gespeichert werden
können. Der Im- bzw. Export von Eisen läuft
über zwei verschiedene Kanäle.











© www.eiseninfo.de
Diagnostik bei Eisenmangel
Es stehen verschiedene diagnostische Parameter zur
Verfügung, um bei einem gegebenen Patienten einen
Eisenmangel zu erkennen und den Schweregrad zu
Das Eisenspeicherprotein Ferritin spielt eine
Schüsselrolle im zellulären Eisenstoffwechsel. Seine
Fähigkeit Eisen zu sequestrieren ist wichtig, um das
essentielle Eisen bei Bedarf aus der Reserve
bereitzustellen, und um das überschüssige, toxische
Eisen zu binden und damit zu entgiften.
. 
Es stehen verschiedene diagnostische Parameter zur
Verfügung, um bei einem gegebenen Patienten einen
Eisenmangel zu erkennen und den Schweregrad zu
erfassen.
Das Eisenspeicherprotein Ferritin spielt eine
Schüsselrolle im zellulären Eisenstoffwechsel. Seine
Fähigkeit Eisen zu sequestrieren ist wichtig, um das
essentielle Eisen bei Bedarf aus der Reserve
bereitzustellen, und um das überschüssige, toxische
Eisen zu binden und damit zu entgiften. 
. 

Eisenmangel
Anlösen von Eisennägeln mit Fruchtsäure (zu wenig wirksam)























