


Eisenspeicherung
Die intrazelluläre Eisenspeicherung wird durch Ferritin und sein Abbauprodukt, Hämosiderin
bewerkstelligt. Apo-Ferritin ist ein sphärisches Protein mit einem äußeren Durchmesser von 12 bis
13 nm und einer inneren Höhle von 7 bis 8 nm (54). Der eisenhaltige Kern von Ferritin ist ein
polymeres Ferrihydrat-Phosphat, das bis zu 4500 Atome enthält (maximale Eisen-Sättigung: 34 %).
Ferritin besteht aus 24 Untereinheiten, wobei es strukturell zwei verschiedene Typen gibt. Die
Isoferritine in verschiedenen Organen unterscheiden sich in der relativen Menge beider
Untereinheiten. In Körpergeweben gibt es ein Mosaik von Heteropolymeren, vom reinen H-Typ bis
zum reinen L-Typ. Es gibt Hinweise, dass H-reiche Ferritine (z.B. in Herz, roten Blutzellen,
Lymphozyten, Monozyten) mehr für die Detoxifikation von Eisen zuständig sind, während L-reiche
Ferritine die Funktion der Langzeit-Speicherung von Eisen wahrnehmen.
Es gibt zwei unterschiedliche Typen von Kanälen in der Apo-Ferritin-Hülle, vier mit hydrophoben
Resten und acht mit sehr polaren Resten. Durch diese Kanäle wird der Transport von Eisen hinein
oder heraus aus dem Käfigmolekül, Apoferritin, bewerkstelligt. Mit der H-Untereinheit, unabhängig
von den beschriebenen Kanälen, ist eine Ferroxidase-Aktivität assoziiert.
Plasma-Ferritin unterscheidet sich von Ferritin aus Gewebe (z.B. Leber) durch die Halbwertszeit im
Plasma (Plasma-Ferritin ca. 30 h, Gewebe-Ferritin 3-30 min). Die Ursache liegt wahrscheinlich im
Kohlenhydratanteil des Plasma-Ferritins. Der Ursprung des Plasma-Ferritins, das in gewissen
Bereichen eine quantitative Aussage über das vorhandene Ganzkörperspeichereisen zulässt
(erschöpfte Eisenspeicher: < 12 µg/l, Eisenüberladung > 300 µg/l), ist nicht geklärt. Es werden die
Meinungen vertreten, dass Serum-Ferritin aus dem RES-System stammt, oder aber auch aus
parenchymalen Zellen.
Im Gegensatz zum kristallisierbaren und dadurch gut definierten Ferritin ist Hämosiderin eine
wasserunlösliche, amorphe Ablagerung. Hämosiderin enthält ein polymeres Eisen(III)-Hydroxid mit
unterschiedlicher Core-Größe. Elektronenmikroskopisch ist Hämosiderin ein elektronen-dichtes
Teilchen mit einem Inter-Partikel-Abstand kleiner als 5 nm oder ein elektronen-dichter Klumpen, in
dem einzelne Partikel nicht zu erkennen sind (55). Im Gegensatz zu Ferritin kommt Hämosiderin
Intrazelluläre Eisenhomöostase
Die wichtigsten Prozesse zur Modulation der Eisenhomöostase in Säugetieren sind die intestinale
Eisenabsorption, der Transport von Eisen zwischen den Organen durch Transferrin, die zelluläre
Aufnahme durch Transferrinrezeptoren, die ausgeprägte Utilisation von Eisen durch die
Erythropoese und seine Speicherung als Ferritin und Hämosiderin. Die verschiedenen
Regulation des Eisenstoffwechsels und zeigen durch pathologische Veränderungen in ihrem
Transferrin Rezeptor und von Ferritin bewerkstelligt, die für eine adäquate Aufnahme von Eisen in
beiden Proteine geschieht posttranskriptional, wobei dafür zwei zytoplasmatische Proteine, IRP1 und
IRP2 (IRP= iron regulatory protein), zuständig sind, die an Haarnadel-Strukturen (IREs = iron
responsive elements) in der 5' oder 3'- untranslatierten Region der betreffenden mRNAs binden
(Abb. 3).
Inzwischen wurden eine Reihe Proteine mit unterschiedlichen Funktionen gefunden, die über das
IRE/IRP-Netzwerk reguliert werden können: H-Ferritin und L-Ferritin (Eisenspeicherung), eALAS
(erythropetische Hämsynthese), Ferroportin (Eisenexport), HIF2alpha (Erythropoese), mAconitase
(Citratzyklus); TfR1 und DMT1 (Eisenaufnahme), CDC14A (Zellzyklus) (56).
IRP1 und IRP2 sind homologe Proteine mit 889 bzw. 964 AS und gehören zur Klasse der Eisen-
Schwefel-Isomerasen. Menschliches IRP1 ähnelt zu 58 % der mitochondrialen Akonitase aus
Schweineherz und ist identisch mit der lange bekannten cytoplasmatischen Akonitase, deren
Funktion damit jetzt erklärt werden kann. Durch den Vergleich mit der Kristall-Struktur dieses genau
charakterisierten Proteins geht man von drei kompakten Domänen aus, die mit einer vierten Domäne
durch ein flexibles Gelenk verbunden sind.
Bei Eisenmangel wird die Initiation der Translation von Ferritin gehemmt (Abb. 4). Die Wirkung auf
die TfR-Biosynthese ist genau umgekehrt. Indem IRP an das IRE in der nicht-translatierten Region
am 3’-Ende (3´-UTR) der mRNA bindet, wird der Nuklease-vermittelte Abbau von TfR-mRNA
gehemmt und die Stabilität der TfR-mRNA damit erhöht, sodass mehr Transferrin-Rezeptor gebildet
wird. . Bei Eisenüberschuss funktioniert dieser Regelkreis so, dass die Synthese von Ferritin
hochgefahren, die von Transferrinrezeptor herunterreguliert wird.
Das menschliche IRP1, das bereits isoliert und kloniert wurde, hat eine hohe Affinität zu der mRNA-
Bindungsstelle (Kd=10-30 pM). Die Akonitasefunktion von IRP1 ist mit einem intakten [4Fe-4S]-
Zentrum aktiv und wird inaktiviert, wenn eines der Eisenatome verloren geht. Umgekehrt verhält es
sich mit der mRNA-Bindungsfähigkeit. Unter Eisenmangelbedingungen ist die Affinität zur
Ein weiterer Befund ist die Beteiligung von Stickstoffmonoxid (NO) an der zellulären
Eisenhomöostase (57). NO kann Eisen aus Eisen-Schwefel-Proteinen freisetzen und damit die IRPs
in die hoch-affine Form überführen. Dies könnte ein Mechanismus für die posttranskriptionelle
Regulation der zellulären Eisenhomöostase, z.B. bei Entzündungen, darstellen. Des Weiteren wird
eine direkte Verbindung zwischen Eisenmetabolismus und oxidativem Stress diskutiert (58). Diese
Annahme basiert auf dem experimentellen Befund, dass H2O2 in-vivo (nicht in-vitro) auf IRP1
einwirkt, so dass die Akonitaseaktivität inaktiviert und die IRE-Bindungsfähigkeit aktiviert wird.
Weniger genau zu erfassen ist allerdings, was oxidativer Stress auf molekularer Ebene genau
darstellt und welche Bedeutung dabei substantiellen Konzentrationen von H2O2 zukommt.
Es wurden knock-out-IRP1- und -IRP2-Mäuse generiert (59). Sie sind lebens- und vermehrungsfähig
und vordergründig phänotypisch wenig beeinträchtigt. Dies gilt aber bei genauer Betrachtung mehr
für IRP1- als IRP2-Mangel-Mäuse. Letztere zeigen eine Akkumulation von Eisen im Gehirn und
entwickeln eine progressive Neurodegeneration mit Tremor, Ataxie und Bradykinesie. Sie entwickeln
auch eine Eisenmangelanämie durch die mangelnde Expression von TfR auf sich entwickelnden
Erythrozyten. IRP2-/- Zellen zeigen einen deutlich fehlregulierten Eisenmetabolismus, wenn Sie
unter 3 – 6 % Sauerstoff gehalten werden, was der physiologischen Sauerstoffkonzentration in
Geweben entspricht. Unter den laborüblichen Bedingungen von Zellkulturen mit 21 % Sauerstoff wird
in IRP2 -/- Zellen IRP1 aktiviert und kann so die fehlende IRP2-Aktivität substituieren. Daraus wird
geschlussfolgert, dass IRP2 und nicht IRP1 die Regulation des Eisenstoffwechsels in
Säugetierzellen unter physiologischen Bedingungen dominiert (59). Die Arbeiten über IRP knock-out
Mäuse legen auch nahe, dass eine Eisenfehlregulation die primäre Ursache für eine
Neurodegeneration sein kann. Es wurde ebenfalls gezeigt, dass Zink und Cadmium mit der IRE-
Bindungsaktivität interferieren und zwar über IRP1, aber nicht über IRP2 und nicht über die
Akonitaseaktivität von IRP1. Diese neuen Daten lassen einen Mechanismus für die biologische
Toxizität von Cadmium und hohen Zinkkonzentrationen vermuten, die durch Wechselwirkung mit
Eine systemische Regulation des Eisenstoffwechsels kontrolliert die Nahrungseisen- absorption im
Darm und die Mobilisierung von Eisen aus den Eisenspeichern, um den Bedarf hauptsächlich für die
Erythropese zu decken (60). Da es keine aktive Ausscheidung von Eisen gibt, muss die Aufnahme
von Eisen fein reguliert sein. Bei ausreichend vorhandenem Körpereisen wird die Eisenabsorption
herunterreguliert, ein Phänomen, das lange bekannt als „Mukosablock“ bezeichnet wurde. Die
Absorption von Nahrungseisen ist vom Eisengehalt der Diät abhängig, ein Mechanismus der als
„Diät-Regulator“ bezeichnet wurde. Ferner muss es einen „Speicher-Regulator“ geben, der die
Eisenkonzentration im Blut detektiert. Dieser Regulator programmiert Enterozyten in Darmkrypten,
die später zu absorbierenden Zottenzellen differenzieren, die dann viel oder wenig Eisen über DMT1
aufnehmen können. Da hier Eisenspeicher in Leber, Muskulatur und Knochenmark mit Darmzellen
zusammenarbeiten, muss es sich um eine lösliche Verbindung handeln, ein Hormon. Ein dritter
Regulator, der „erythopoetische Regulator, hat bei Eisenmangel direkt Einfluss auf die
Eisenabsorption und wirkt stärker als der Speicher-Regulator. Die zelluläre Retention von Eisen bei
Infektion/Entzündung oder Tumorerkrankungen mag ein weiterer Mechanismus sein, um den
Wachstumsfaktor Eisen z.B. von invasiven Bakterien fernzuhalten. Dies könnte man als
Ein neues Bild von der Regulation des Eisenstoffwechsels ergab sich durch die Entdeckung von
Hepcidin, als Hormon und negativer Regulator des Eisenstoffwechsels (21-23, 61, 62). Zusammen
Membran von Mitochondrien Cytochrome, die wesentliche Funktionen bei der oxidativen
Phosphorylierung einnehmen. Zu den eisenhaltigen Oxidoreduktasen gehört z.B. die
Ribonukleotidreduktase, das Schlüsselenzym der DNA-Synthese. Die Cytochrom P450-Familie
katalysiert hunderte von Reaktionen im Fremdstoffmetabolismus. Fettsäuredesaturasen,
Lipoxygenasen, Peroxidasen, NO-Synthetasen, die Akonitase im Citratcyclus, die Guanylatcyclase
(Signaltransduktion, second messenger) und die Aminophosporibosyltransferase (Purinsynthese)
Der menschliche Körper eines Erwachsenen enthält 3-5 g Eisen hauptsächlich in Form von
Hämoglobin, als Häm- oder nicht-Häm-Eisen-Enzymen und als Depot-Eisen, gespeichert in Ferritin
und Hämosiderin (Tabelle 1). Der tägliche physiologische Eisenverlust in Form von abgeschilferten
Epithelzellen der äußeren und inneren Körperoberflächen, sowie durch Schweiß und Urin beträgt

Die intrazelluläre Eisenspeicherung wird durch Ferritin und sein Abbauprodukt, Hämosiderin
bewerkstelligt. Apo-Ferritin ist ein sphärisches Protein mit einem äußeren Durchmesser von 12 bis
13 nm und einer inneren Höhle von 7 bis 8 nm (54). Der eisenhaltige Kern von Ferritin ist ein
polymeres Ferrihydrat-Phosphat, das bis zu 4500 Atome enthält (maximale Eisen-Sättigung: 34 %).
Ferritin besteht aus 24 Untereinheiten, wobei es strukturell zwei verschiedene Typen gibt. Die
Isoferritine in verschiedenen Organen unterscheiden sich in der relativen Menge beider
Untereinheiten. In Körpergeweben gibt es ein Mosaik von Heteropolymeren, vom reinen H-Typ bis
zum reinen L-Typ. Es gibt Hinweise, dass H-reiche Ferritine (z.B. in Herz, roten Blutzellen,
Lymphozyten, Monozyten) mehr für die Detoxifikation von Eisen zuständig sind, während L-reiche
Ferritine die Funktion der Langzeit-Speicherung von Eisen wahrnehmen. 
Es gibt zwei unterschiedliche Typen von Kanälen in der Apo-Ferritin-Hülle, vier mit hydrophoben
Resten und acht mit sehr polaren Resten. Durch diese Kanäle wird der Transport von Eisen hinein
oder heraus aus dem Käfigmolekül, Apoferritin, bewerkstelligt. Mit der H-Untereinheit, unabhängig
von den beschriebenen Kanälen, ist eine Ferroxidase-Aktivität assoziiert. 
Plasma-Ferritin unterscheidet sich von Ferritin aus Gewebe (z.B. Leber) durch die Halbwertszeit im
Plasma (Plasma-Ferritin ca. 30 h, Gewebe-Ferritin 3-30 min). Die Ursache liegt wahrscheinlich im
Kohlenhydratanteil des Plasma-Ferritins. Der Ursprung des Plasma-Ferritins, das in gewissen
Bereichen eine quantitative Aussage über das vorhandene Ganzkörperspeichereisen zulässt
(erschöpfte Eisenspeicher: < 12 µg/l, Eisenüberladung > 300 µg/l), ist nicht geklärt. Es werden die
Meinungen vertreten, dass Serum-Ferritin aus dem RES-System stammt, oder aber auch aus
parenchymalen Zellen. 
Im Gegensatz zum kristallisierbaren und dadurch gut definierten Ferritin ist Hämosiderin eine
wasserunlösliche, amorphe Ablagerung. Hämosiderin enthält ein polymeres Eisen(III)-Hydroxid mit
unterschiedlicher Core-Größe. Elektronenmikroskopisch ist Hämosiderin ein elektronen-dichtes
Teilchen mit einem Inter-Partikel-Abstand kleiner als 5 nm oder ein elektronen-dichter Klumpen, in
dem einzelne Partikel nicht zu erkennen sind (55). Im Gegensatz zu Ferritin kommt Hämosiderin
ausschließlich in Siderosomen vor.
Intrazelluläre Eisenhomöostase 
Die wichtigsten Prozesse zur Modulation der Eisenhomöostase in Säugetieren sind die intestinale
Eisenabsorption, der Transport von Eisen zwischen den Organen durch Transferrin, die zelluläre
Aufnahme durch Transferrinrezeptoren, die ausgeprägte Utilisation von Eisen durch die 
Erythropoese und seine Speicherung als Ferritin und Hämosiderin. Die verschiedenen
eisenbindenden Proteine bewirken durch ihre jeweilige Expression mechanistisch die physiologische
Regulation des Eisenstoffwechsels und zeigen durch pathologische Veränderungen in ihrem
Wechselspiel auch Störungen des Eisenstoffwechsels an.
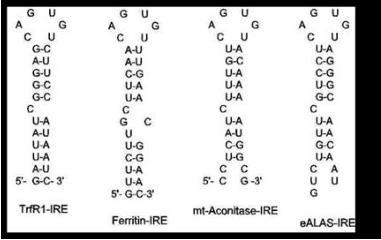
Abb 3: Haarnadelstrukturen von „iron-responsive elements“ (IREs) auf der mRNA von regulierbaren Proteinen
im Eisenstoffwechsel.
Regulation durch IREs und IRPs
Die Eisenhomöostase auf zellulärem Niveau wird durch eine dem Bedarf angepasste Expression von
Transferrin Rezeptor und von Ferritin bewerkstelligt, die für eine adäquate Aufnahme von Eisen in
die Zelle und seine Speicherung sorgen (aktueller Review 56). Die Regulation der Expression dieser
beiden Proteine geschieht posttranskriptional, wobei dafür zwei zytoplasmatische Proteine, IRP1 und
IRP2 (IRP= iron regulatory protein), zuständig sind, die an Haarnadel-Strukturen (IREs = iron
responsive elements) in der 5' oder 3'- untranslatierten Region der betreffenden mRNAs binden
(Abb. 3). 
Inzwischen wurden eine Reihe Proteine mit unterschiedlichen Funktionen gefunden, die über das
IRE/IRP-Netzwerk reguliert werden können: H-Ferritin und L-Ferritin (Eisenspeicherung), eALAS
(erythropetische Hämsynthese), Ferroportin (Eisenexport), HIF2alpha (Erythropoese), mAconitase
(Citratzyklus); TfR1 und DMT1 (Eisenaufnahme), CDC14A (Zellzyklus) (56). 
IRP1 und IRP2 sind homologe Proteine mit 889 bzw. 964 AS und gehören zur Klasse der Eisen-
Schwefel-Isomerasen. Menschliches IRP1 ähnelt zu 58 % der mitochondrialen Akonitase aus
Schweineherz und ist identisch mit der lange bekannten cytoplasmatischen Akonitase, deren
Funktion damit jetzt erklärt werden kann. Durch den Vergleich mit der Kristall-Struktur dieses genau
charakterisierten Proteins geht man von drei kompakten Domänen aus, die mit einer vierten Domäne
durch ein flexibles Gelenk verbunden sind. 
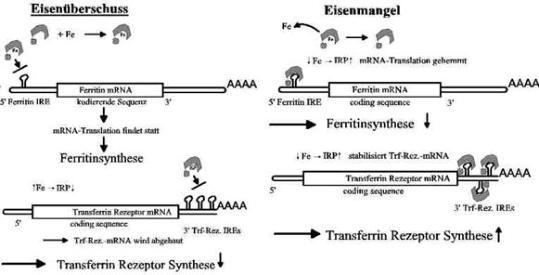
Bei Eisenmangel wird die Initiation der Translation von Ferritin gehemmt (Abb. 4). Die Wirkung auf
die TfR-Biosynthese ist genau umgekehrt. Indem IRP an das IRE in der nicht-translatierten Region
am 3’-Ende (3´-UTR) der mRNA bindet, wird der Nuklease-vermittelte Abbau von TfR-mRNA
gehemmt und die Stabilität der TfR-mRNA damit erhöht, sodass mehr Transferrin-Rezeptor gebildet
wird. . Bei Eisenüberschuss funktioniert dieser Regelkreis so, dass die Synthese von Ferritin
hochgefahren, die von Transferrinrezeptor herunterreguliert wird. 
Das menschliche IRP1, das bereits isoliert und kloniert wurde, hat eine hohe Affinität zu der mRNA-
Bindungsstelle (Kd=10-30 pM). Die Akonitasefunktion von IRP1 ist mit einem intakten [4Fe-4S]-
Zentrum aktiv und wird inaktiviert, wenn eines der Eisenatome verloren geht. Umgekehrt verhält es
sich mit der mRNA-Bindungsfähigkeit. Unter Eisenmangelbedingungen ist die Affinität zur
Bindungsstelle sehr hoch.
Ein weiterer Befund ist die Beteiligung von Stickstoffmonoxid (NO) an der zellulären
Eisenhomöostase (57). NO kann Eisen aus Eisen-Schwefel-Proteinen freisetzen und damit die IRPs
in die hoch-affine Form überführen. Dies könnte ein Mechanismus für die posttranskriptionelle
Regulation der zellulären Eisenhomöostase, z.B. bei Entzündungen, darstellen. Des Weiteren wird
eine direkte Verbindung zwischen Eisenmetabolismus und oxidativem Stress diskutiert (58). Diese
Annahme basiert auf dem experimentellen Befund, dass H2O2 in-vivo (nicht in-vitro) auf IRP1
einwirkt, so dass die Akonitaseaktivität inaktiviert und die IRE-Bindungsfähigkeit aktiviert wird.
Weniger genau zu erfassen ist allerdings, was oxidativer Stress auf molekularer Ebene genau
darstellt und welche Bedeutung dabei substantiellen Konzentrationen von H2O2 zukommt. 
Es wurden knock-out-IRP1- und -IRP2-Mäuse generiert (59). Sie sind lebens- und vermehrungsfähig
und vordergründig phänotypisch wenig beeinträchtigt. Dies gilt aber bei genauer Betrachtung mehr
für IRP1- als IRP2-Mangel-Mäuse. Letztere zeigen eine Akkumulation von Eisen im Gehirn und
entwickeln eine progressive Neurodegeneration mit Tremor, Ataxie und Bradykinesie. Sie entwickeln
auch eine Eisenmangelanämie durch die mangelnde Expression von TfR auf sich entwickelnden
Erythrozyten. IRP2-/- Zellen zeigen einen deutlich fehlregulierten Eisenmetabolismus, wenn Sie
unter 3 – 6 % Sauerstoff gehalten werden, was der physiologischen Sauerstoffkonzentration in
Geweben entspricht. Unter den laborüblichen Bedingungen von Zellkulturen mit 21 % Sauerstoff wird
in IRP2 -/- Zellen IRP1 aktiviert und kann so die fehlende IRP2-Aktivität substituieren. Daraus wird
geschlussfolgert, dass IRP2 und nicht IRP1 die Regulation des Eisenstoffwechsels in
Säugetierzellen unter physiologischen Bedingungen dominiert (59). Die Arbeiten über IRP knock-out
Mäuse legen auch nahe, dass eine Eisenfehlregulation die primäre Ursache für eine
Neurodegeneration sein kann. Es wurde ebenfalls gezeigt, dass Zink und Cadmium mit der IRE-
Bindungsaktivität interferieren und zwar über IRP1, aber nicht über IRP2 und nicht über die
Akonitaseaktivität von IRP1. Diese neuen Daten lassen einen Mechanismus für die biologische
Toxizität von Cadmium und hohen Zinkkonzentrationen vermuten, die durch Wechselwirkung mit
dem Eisenstoffwechsel zustande kommt.
Abb. 4: Posttranskriptionale Regulation der Transferrin-Rezeptor- und der Ferrritin-Synthese
Regulation der systemischen Eisenhomeostase
Eine systemische Regulation des Eisenstoffwechsels kontrolliert die Nahrungseisen- absorption im
Darm und die Mobilisierung von Eisen aus den Eisenspeichern, um den Bedarf hauptsächlich für die
Erythropese zu decken (60). Da es keine aktive Ausscheidung von Eisen gibt, muss die Aufnahme
von Eisen fein reguliert sein. Bei ausreichend vorhandenem Körpereisen wird die Eisenabsorption
herunterreguliert, ein Phänomen, das lange bekannt als „Mukosablock“ bezeichnet wurde. Die
Absorption von Nahrungseisen ist vom Eisengehalt der Diät abhängig, ein Mechanismus der als
„Diät-Regulator“ bezeichnet wurde. Ferner muss es einen „Speicher-Regulator“ geben, der die
Eisenkonzentration im Blut detektiert. Dieser Regulator programmiert Enterozyten in Darmkrypten,
die später zu absorbierenden Zottenzellen differenzieren, die dann viel oder wenig Eisen über DMT1
aufnehmen können. Da hier Eisenspeicher in Leber, Muskulatur und Knochenmark mit Darmzellen
zusammenarbeiten, muss es sich um eine lösliche Verbindung handeln, ein Hormon. Ein dritter
Regulator, der „erythopoetische Regulator, hat bei Eisenmangel direkt Einfluss auf die
Eisenabsorption und wirkt stärker als der Speicher-Regulator. Die zelluläre Retention von Eisen bei 
Infektion/Entzündung oder Tumorerkrankungen mag ein weiterer Mechanismus sein, um den
Wachstumsfaktor Eisen z.B. von invasiven Bakterien fernzuhalten. Dies könnte man als
„Entzündungs-Regulator“ ansprechen.
Ein neues Bild von der Regulation des Eisenstoffwechsels ergab sich durch die Entdeckung von
Hepcidin, als Hormon und negativer Regulator des Eisenstoffwechsels (21-23, 61, 62). Zusammen
Membran von Mitochondrien Cytochrome, die wesentliche Funktionen bei der oxidativen
Phosphorylierung einnehmen. Zu den eisenhaltigen Oxidoreduktasen gehört z.B. die
Ribonukleotidreduktase, das Schlüsselenzym der DNA-Synthese. Die Cytochrom P450-Familie
katalysiert hunderte von Reaktionen im Fremdstoffmetabolismus. Fettsäuredesaturasen,
Lipoxygenasen, Peroxidasen, NO-Synthetasen, die Akonitase im Citratcyclus, die Guanylatcyclase
(Signaltransduktion, second messenger) und die Aminophosporibosyltransferase (Purinsynthese)
sind gleichfalls eisenhaltige Enzyme (5, 6).
Der menschliche Körper eines Erwachsenen enthält 3-5 g Eisen hauptsächlich in Form von
Hämoglobin, als Häm- oder nicht-Häm-Eisen-Enzymen und als Depot-Eisen, gespeichert in Ferritin
und Hämosiderin (Tabelle 1). Der tägliche physiologische Eisenverlust in Form von abgeschilferten
Epithelzellen der äußeren und inneren Körperoberflächen, sowie durch Schweiß und Urin beträgt
insgesamt ca. 1-2 mg und ist nicht regulierbar.












© www.eiseninfo.de
Eisenstoffwechsel
Um Eisen gefahrlos nutzen zu können wurde ein
kompliziertes System von feinregulierter
Aufnahme, Transport und Speichermechanismen
geschaffen, damit im Normalzustand eine
ausgeglichene Eisenbilanz sichergestellt wird.


Eisenmangel
altertümliche Therapie des Eisenmangels (wenig wirksam!)









