



Messung von Organeisen mit Magnetresonanztomographie (MRT)
Quantitative Magnetresonanz-Tomographie der Leber
Gemäß Gleichung 2 wird die Größe des resonanten Radiowellensignals der Protonen (65.2 MHz bei 1.5 Tesla) in der Detektorspule eines MRI- Geräts von der Kern-Magnetisierung M(r) aller Protonen im jeweiligen Volumenelement dV des Körpers, der Detektor-Konfiguration und dem
Geräts von der Kern-Magnetisierung M(r) aller Protonen im jeweiligen Volumenelement dV des Körpers, der Detektor-Konfiguration und dem Abstand r zur Detektorspule bestimmt. Anders als bei der Suszeptometrie gibt es jedoch nach heutigem Kenntnisstand keine befriedigende
Abstand r zur Detektorspule bestimmt. Anders als bei der Suszeptometrie gibt es jedoch nach heutigem Kenntnisstand keine befriedigende quantitative Theorie für die Wechselwirkung von Eisenatomen mit der Kernmagnetisierung der Protonen (38). und für die daraus resultierende
quantitative Theorie für die Wechselwirkung von Eisenatomen mit der Kernmagnetisierung der Protonen (38). und für die daraus resultierende longitudinale und transversale Relaxation (R1 = 1/T1 und R2 = 1/T2). Darüber hinaus wird die Wechselwirkung der Protonen mit einem
longitudinale und transversale Relaxation (R1 = 1/T1 und R2 = 1/T2). Darüber hinaus wird die Wechselwirkung der Protonen mit einem magnetischen Zentrum von einer Reihe von Parametern beeinflusst wie der Zahl der Protonen-Liganden, ihrer Beweglichkeit (correlation time),
der Größe der Ferritin- und Hämosiderin-Molekül-Cluster, unterschiedliche Protonen-Pools, etc. Diese komplexen Zusammenhänge eröffnen
magnetischen Zentrum von einer Reihe von Parametern beeinflusst wie der Zahl der Protonen-Liganden, ihrer Beweglichkeit (correlation time),
der Größe der Ferritin- und Hämosiderin-Molekül-Cluster, unterschiedliche Protonen-Pools, etc. Diese komplexen Zusammenhänge eröffnen andererseits auch die Möglichkeit zusätzliche Informationen über Hämosiderin- und Ferritin-Eisenverteilung zu erhalten (39). Die eisen-
andererseits auch die Möglichkeit zusätzliche Informationen über Hämosiderin- und Ferritin-Eisenverteilung zu erhalten (39). Die eisen- spezifische in vivo MR-Tomographie von 57Fe ist wegen der sehr kleinen Sensitivität (1H : 57Fe = 1 : 10-5) und der z. Zt. erreichbaren
spezifische in vivo MR-Tomographie von 57Fe ist wegen der sehr kleinen Sensitivität (1H : 57Fe = 1 : 10-5) und der z. Zt. erreichbaren Magnetfeldstärken nicht möglich.
Trotz aller Komplexität bietet die quantitative MRI-Eisenbestimmung auch eine Reihe von Vorteilen, wenn die nötige Expertise vorhanden ist.
Magnetfeldstärken nicht möglich.
Trotz aller Komplexität bietet die quantitative MRI-Eisenbestimmung auch eine Reihe von Vorteilen, wenn die nötige Expertise vorhanden ist. Diese beruhen hauptsächlich auf der 3-dimensionalen Lokalisation (Bildgebung) und der Erfassung von tiefliegenden Organregionen. Seit Mitte
Diese beruhen hauptsächlich auf der 3-dimensionalen Lokalisation (Bildgebung) und der Erfassung von tiefliegenden Organregionen. Seit Mitte der 90er Jahre haben sich verschiedene MRI-Methoden zur Erfassung des Lebereisens herauskristallisiert, die laufend eine Verbesserung durch
der 90er Jahre haben sich verschiedene MRI-Methoden zur Erfassung des Lebereisens herauskristallisiert, die laufend eine Verbesserung durch homogenere Magnetfelder und kürzere Echozeiten erfahren haben. Es soll hier nur auf die Single-Spin-Echo Methode (SSE) zur Bestimmung der
homogenere Magnetfelder und kürzere Echozeiten erfahren haben. Es soll hier nur auf die Single-Spin-Echo Methode (SSE) zur Bestimmung der transversalen Relaxationszeit T2 eingegangen werden (40-42), die heute als anerkanntes quantitatives Verfahren zur Lebereisenbestimmung
transversalen Relaxationszeit T2 eingegangen werden (40-42), die heute als anerkanntes quantitatives Verfahren zur Lebereisenbestimmung und seiner 2-dimensionalen Verteilung (liver iron imaging) mit standardisiertem Messprotokoll und zentraler Analyse (Ferriscan®) weltweit zur
und seiner 2-dimensionalen Verteilung (liver iron imaging) mit standardisiertem Messprotokoll und zentraler Analyse (Ferriscan®) weltweit zur Verfügung steht (43).
Bei dem Spin-Echo Verfahren klingen die in der Detektorspule empfangenen Radiowellen-Signal-Intensitäten SI der Echos, die durch
Verfügung steht (43).
Bei dem Spin-Echo Verfahren klingen die in der Detektorspule empfangenen Radiowellen-Signal-Intensitäten SI der Echos, die durch Anregungsimpulse im Abstand einer gewählten Echozeit TE erzeugt werden, exponentiell mit der transversalen oder Spin-Spin-Relaxationszeit
Anregungsimpulse im Abstand einer gewählten Echozeit TE erzeugt werden, exponentiell mit der transversalen oder Spin-Spin-Relaxationszeit T2 ab. In erster Näherung gilt die Gleichung 4 mit den neben T2 zu bestimmenden Signalintensitäten SI bei TE = 0 und bei TE → ∞.
T2 ab. In erster Näherung gilt die Gleichung 4 mit den neben T2 zu bestimmenden Signalintensitäten SI bei TE = 0 und bei TE → ∞.  (4)
SI (TE) = SIo · EXP(-TE/T2) + SI∞
(4)
SI (TE) = SIo · EXP(-TE/T2) + SI∞ (transversale Relaxation)
(transversale Relaxation)  Bei der SSE-Methode wird nur das qualitativ beste 1. Echo registriert und die Echozeit wird variiert. Die Funktion 4.4 wird an die resultierenden
Bei der SSE-Methode wird nur das qualitativ beste 1. Echo registriert und die Echozeit wird variiert. Die Funktion 4.4 wird an die resultierenden Signal-Intensitäten angepasst. Bei Vorhandensein von mehreren Protonenpools mit unterschiedlichem Relaxationsverhalten muss die mono-
Signal-Intensitäten angepasst. Bei Vorhandensein von mehreren Protonenpools mit unterschiedlichem Relaxationsverhalten muss die mono- exponentielle Funktion 4 zu einer bi- oder multi-exponentiellen Funktion erweitert werden (43). Ob ein bi-exponentielles Modell für die Leber
wirklich bessere Resultate liefert oder angesichts der verwendeten Echozeiten und dem z. Zt. erreichbaren Signal-Rausch-Verhältnis der MRI-
exponentielle Funktion 4 zu einer bi- oder multi-exponentiellen Funktion erweitert werden (43). Ob ein bi-exponentielles Modell für die Leber
wirklich bessere Resultate liefert oder angesichts der verwendeten Echozeiten und dem z. Zt. erreichbaren Signal-Rausch-Verhältnis der MRI- Tomographen überstrapaziert zu sein scheint, müssen zukünftige Forschungen zeigen (44).
Abb. 5: Eisenverteilung in einer 5 mm Leberschicht eines Patienten mit HbE/b-Thalassämie (29 y, HCV+) (1.5 T Philips Intera Gyroscan®, CHRCO-
Tomographen überstrapaziert zu sein scheint, müssen zukünftige Forschungen zeigen (44).
Abb. 5: Eisenverteilung in einer 5 mm Leberschicht eines Patienten mit HbE/b-Thalassämie (29 y, HCV+) (1.5 T Philips Intera Gyroscan®, CHRCO- Oakland, USA) mit einer durchschnittlichen Lebereisen-Konzentration von 18.6 mg/gdry wgt (Ferriscan®). Die transversale Relaxation R2 pro
Oakland, USA) mit einer durchschnittlichen Lebereisen-Konzentration von 18.6 mg/gdry wgt (Ferriscan®). Die transversale Relaxation R2 pro Volumenelement und somit die Eisenverteilung variiert von 6.0 mg/gdry wgt (rot: R2 ≥ 92 s-1) bis 30.5 mg/gdry wgt (gelb: R2 280 ≤ s-1).
Volumenelement und somit die Eisenverteilung variiert von 6.0 mg/gdry wgt (rot: R2 ≥ 92 s-1) bis 30.5 mg/gdry wgt (gelb: R2 280 ≤ s-1). 
 In Abbildung 5 ist die SSE-Methode mittels Ferriscan®-Analyse (43) exemplarisch für einen transfundierten Patienten mit HbE/b-Thalassämie
In Abbildung 5 ist die SSE-Methode mittels Ferriscan®-Analyse (43) exemplarisch für einen transfundierten Patienten mit HbE/b-Thalassämie gezeigt, bei dem aufgrund klinischer Daten (Ferritin: 6600 µg/l, ALT: 200 U/l, Transfusion: 100 ml/kg/Jahr Deferoxamin-Chelatordosis: 10
gezeigt, bei dem aufgrund klinischer Daten (Ferritin: 6600 µg/l, ALT: 200 U/l, Transfusion: 100 ml/kg/Jahr Deferoxamin-Chelatordosis: 10 mg/kg/d) der Verdacht bestand, dass das Lebereisen durch SQUID-BLS (LIC ≈ 11.3 mg/gdry wgt) unterrepräsentiert würde. Die exponentielle
mg/kg/d) der Verdacht bestand, dass das Lebereisen durch SQUID-BLS (LIC ≈ 11.3 mg/gdry wgt) unterrepräsentiert würde. Die exponentielle Modell-Funktion zur Ermittlung der transversalen Relaxationen R2 wird an die gemittelten Signalintensitäten pro Volumenelement (ca. 10 mm3)
in Abhängigkeit von den Echozeiten angepasst (A1 ... An). Daraus wird dann für eine repräsentative Leberschicht das R2-Bild berechnet und
Modell-Funktion zur Ermittlung der transversalen Relaxationen R2 wird an die gemittelten Signalintensitäten pro Volumenelement (ca. 10 mm3)
in Abhängigkeit von den Echozeiten angepasst (A1 ... An). Daraus wird dann für eine repräsentative Leberschicht das R2-Bild berechnet und dargestellt (B). Aus dem R2-Histogramm (C) wird dann mittels nicht-linearer Kalibrierkurve (D), die zuvor aus den gefriergetrockneten
dargestellt (B). Aus dem R2-Histogramm (C) wird dann mittels nicht-linearer Kalibrierkurve (D), die zuvor aus den gefriergetrockneten Leberbiopsien von 105 Patienten mit b-Thalassämie, hereditärer Hämochromatose und von HCV infizierten Patienten erstellt worden ist (43),
Leberbiopsien von 105 Patienten mit b-Thalassämie, hereditärer Hämochromatose und von HCV infizierten Patienten erstellt worden ist (43),  die mittlere Lebereisenkonzentration berechnet.
Herzeisenquantifizierung
Auch wenn die Hauptmenge an Eisen bei Eisenüberladungs-Krankheiten in der Leber akkumuliert wird, kann es auch in anderen Organen zu
die mittlere Lebereisenkonzentration berechnet.
Herzeisenquantifizierung
Auch wenn die Hauptmenge an Eisen bei Eisenüberladungs-Krankheiten in der Leber akkumuliert wird, kann es auch in anderen Organen zu kritischen Eisenkonzentrationen kommen, was klinisch viel größere Beedeutng haben kann.. Insbesondere bei Transfusions-Siderosen sind
kritischen Eisenkonzentrationen kommen, was klinisch viel größere Beedeutng haben kann.. Insbesondere bei Transfusions-Siderosen sind lebensbedrohliche Kardiomyopathien und Herzrhythmusstörungen mit einer Eisenüberladung des Herzens in Verbindung gebracht worden (45),
während Herzprobleme bei hereditärer Hämochromatose eher selten vorkommen (46). In einer der repräsentativsten Studien zum Überleben
lebensbedrohliche Kardiomyopathien und Herzrhythmusstörungen mit einer Eisenüberladung des Herzens in Verbindung gebracht worden (45),
während Herzprobleme bei hereditärer Hämochromatose eher selten vorkommen (46). In einer der repräsentativsten Studien zum Überleben von 1146 Patienten mit b-Thalassaemia major, die zwischen 1960 und 1987 geboren worden sind, wurde Herzversagen als häufigste
von 1146 Patienten mit b-Thalassaemia major, die zwischen 1960 und 1987 geboren worden sind, wurde Herzversagen als häufigste Todesursache (60 %) gefunden (5). Diese Überlebensstudien und die Erfolge der Intensiv-Chelatorbehandlung bei Herzproblemen führten zu der
Vorstellung, dass Patienten mit optimalen Eisenspeichern und an die Bluttransfusions-Rate angepasstem Chelator-Regime ein geringes Risiko für
Herzprobleme zu erwarten hätten (27).
In den letzten Jahren wurden jedoch neuere Befunde erhoben, die bei ß-Thalassaemia major keinen Zusammenhang zwischen der Häufigkeit
Todesursache (60 %) gefunden (5). Diese Überlebensstudien und die Erfolge der Intensiv-Chelatorbehandlung bei Herzproblemen führten zu der
Vorstellung, dass Patienten mit optimalen Eisenspeichern und an die Bluttransfusions-Rate angepasstem Chelator-Regime ein geringes Risiko für
Herzprobleme zu erwarten hätten (27).
In den letzten Jahren wurden jedoch neuere Befunde erhoben, die bei ß-Thalassaemia major keinen Zusammenhang zwischen der Häufigkeit von Herzproblemen und erhöhten Eisenspeicher-Parametern wie Ferritin und Lebereisenkonzentration aufzeigen. Mit einer neuen MRI-T2*-
von Herzproblemen und erhöhten Eisenspeicher-Parametern wie Ferritin und Lebereisenkonzentration aufzeigen. Mit einer neuen MRI-T2*- Methode wurde diese scheinbar paradoxe Situation direkt bestätigt, indem kurze T2*-Relaxationszeiten (mehr Eisen) auch im Herzen von gut
Methode wurde diese scheinbar paradoxe Situation direkt bestätigt, indem kurze T2*-Relaxationszeiten (mehr Eisen) auch im Herzen von gut chelierten Patienten mit niedrigem LIC gefunden wurden (8). Im Gegensatz dazu wurde in Studien an MDS-Patienten mit mehr klassischen MRI-
chelierten Patienten mit niedrigem LIC gefunden wurden (8). Im Gegensatz dazu wurde in Studien an MDS-Patienten mit mehr klassischen MRI- Methoden (spin-echo T2, SIR = signal intensity ratio) eine signifikante Korrelation zwischen MRI-Parametern im Herzen und LIC bzw. Ferritin
Methoden (spin-echo T2, SIR = signal intensity ratio) eine signifikante Korrelation zwischen MRI-Parametern im Herzen und LIC bzw. Ferritin gefunden (47).
Aktuell finden quantitative MRI-T2*-Herz-Messungen im Zusammenhang mit der klinischen Testung von neuen oralen Eisenchelatoren
gefunden (47).
Aktuell finden quantitative MRI-T2*-Herz-Messungen im Zusammenhang mit der klinischen Testung von neuen oralen Eisenchelatoren (Deferipron, Deferasirox) oder Chelator-Kombinationen (Deferoxamin & Deferipron) große Beachtung, da es möglicherweise Unterschiede in
(Deferipron, Deferasirox) oder Chelator-Kombinationen (Deferoxamin & Deferipron) große Beachtung, da es möglicherweise Unterschiede in der Effizienz von verschiedenen Chelatoren gibt, das klinisch offenbar bedeutsame Speichereisen im Herzen zu entfernen (48, 49).
Autopsie- und Endokard-Biopsie
Im Gegensatz zur Leber wird die direkte physikalisch-chemische Bestimmung der Herzeisen-Konzentration (HIC = heart iron concentration) in
der Effizienz von verschiedenen Chelatoren gibt, das klinisch offenbar bedeutsame Speichereisen im Herzen zu entfernen (48, 49).
Autopsie- und Endokard-Biopsie
Im Gegensatz zur Leber wird die direkte physikalisch-chemische Bestimmung der Herzeisen-Konzentration (HIC = heart iron concentration) in einer Katheter-Biopsie eher selten durchgeführt und ist wegen der Inhomogenität der Eisenverteilung im Myokard-Gewebe auch nicht
einer Katheter-Biopsie eher selten durchgeführt und ist wegen der Inhomogenität der Eisenverteilung im Myokard-Gewebe auch nicht repräsentativ für das gesamte Herzeisen (50, 51).
repräsentativ für das gesamte Herzeisen (50, 51).  In Autopsie-Herzen mit signifikanter histologischer Eisenfärbung haben Buja und Roberts (52) HIC-Werte zwischen 160 und 1470 µg-Fe/gwet
In Autopsie-Herzen mit signifikanter histologischer Eisenfärbung haben Buja und Roberts (52) HIC-Werte zwischen 160 und 1470 µg-Fe/gwet weigt gefunden. Von Interesse für nicht-invasive Methoden dürfte auch das relativ hohe Feucht-zu-Trockengewichts-Verhältnis von 6.5 ± 0.6
weigt gefunden. Von Interesse für nicht-invasive Methoden dürfte auch das relativ hohe Feucht-zu-Trockengewichts-Verhältnis von 6.5 ± 0.6 sein. Alle Patienten mit HIC > 600 µg-Fe/gwet weigt von mehr als 23 g transfundierten Eisen hatten eine Herzinsuffizienz entwickelt. Außerdem
sein. Alle Patienten mit HIC > 600 µg-Fe/gwet weigt von mehr als 23 g transfundierten Eisen hatten eine Herzinsuffizienz entwickelt. Außerdem wurde ein Eisengradient im Myokard mit mehr Eisen im Epikard beobachtet. In Autopsie-Herzen von Patienten mit hereditärer
wurde ein Eisengradient im Myokard mit mehr Eisen im Epikard beobachtet. In Autopsie-Herzen von Patienten mit hereditärer Hämochromatose wurden HIC-Werte > 500 µg-Fe/gwet weigt (normal: 20 - 125µg-Fe/gwet weigt) im gesamten links-ventrikulären Herzmuskel
Hämochromatose wurden HIC-Werte > 500 µg-Fe/gwet weigt (normal: 20 - 125µg-Fe/gwet weigt) im gesamten links-ventrikulären Herzmuskel und im Septum gefunden (53). In einer anderen Autopsie-Studie in Patienten mit HbE/b-Thalassämie, die an kardialer Hypertrophie litten,
und im Septum gefunden (53). In einer anderen Autopsie-Studie in Patienten mit HbE/b-Thalassämie, die an kardialer Hypertrophie litten, waren in Histologie-Schnitten nur leichte Eisenfärbungen sichtbar (54).
Quantitative Magnetresonanz-Tomographie des Herzens
waren in Histologie-Schnitten nur leichte Eisenfärbungen sichtbar (54).
Quantitative Magnetresonanz-Tomographie des Herzens  Von allen nicht-invasiven Methoden zur Messung des Herzeisens erscheint zur Zeit die Magnetresonanz-Tomographie am vielversprechendsten
Von allen nicht-invasiven Methoden zur Messung des Herzeisens erscheint zur Zeit die Magnetresonanz-Tomographie am vielversprechendsten zu sein (47). Insbesondere ist die MRI-T2*-Methode für die Messung der vergleichsweise niedrigen Herzeisen-Konzentration (s. Kap. 4.3.1)
zu sein (47). Insbesondere ist die MRI-T2*-Methode für die Messung der vergleichsweise niedrigen Herzeisen-Konzentration (s. Kap. 4.3.1) sensitiver als die mehr klassischen MRI-Methoden (T2, SIR). Die transversale „magnetische“ Relaxation R2* = 1/T2* kennzeichnet den Zerfall der
sensitiver als die mehr klassischen MRI-Methoden (T2, SIR). Die transversale „magnetische“ Relaxation R2* = 1/T2* kennzeichnet den Zerfall der Protonenresonanz in der Umgebung lokaler Magnetfelder (Suszeptibilitäts-Effekte). Sie ist in erster Näherung der Summeneffekt aus der
Protonenresonanz in der Umgebung lokaler Magnetfelder (Suszeptibilitäts-Effekte). Sie ist in erster Näherung der Summeneffekt aus der transversalen Relaxation 1/T2, die die Wechselwirkung mit den Kernspins der Nachbarprotonen kennzeichnet, und der Wechselwirkung mit den
umgebenden Magnetfeld-Inhomogenitäten (nicht-rephasierende technische Eigenschaften und/oder lokale magnetische Momente von
transversalen Relaxation 1/T2, die die Wechselwirkung mit den Kernspins der Nachbarprotonen kennzeichnet, und der Wechselwirkung mit den
umgebenden Magnetfeld-Inhomogenitäten (nicht-rephasierende technische Eigenschaften und/oder lokale magnetische Momente von Nachbaratomen) (Gleichung 4.5) (19).
(4.5)
R2* = 1/T2* = 1/T2 + 1/T’(transversale „magnetische“ Relaxationszeit T2*)
Nachbaratomen) (Gleichung 4.5) (19).
(4.5)
R2* = 1/T2* = 1/T2 + 1/T’(transversale „magnetische“ Relaxationszeit T2*)  Um die relativ kleinen magnetischen Suszeptibilitätseffekte der Nachbaratome genügend präzise zu messen (T2* < T2), erfordert diese Methode
Um die relativ kleinen magnetischen Suszeptibilitätseffekte der Nachbaratome genügend präzise zu messen (T2* < T2), erfordert diese Methode allerdings sehr homogene Magnetfelder ≥ 1.5 Tesla im Beobachtungsfenster, kurze Echozeiten (TE < 3 ms) und die Lokalisation einer optimalen
allerdings sehr homogene Magnetfelder ≥ 1.5 Tesla im Beobachtungsfenster, kurze Echozeiten (TE < 3 ms) und die Lokalisation einer optimalen Messschicht. Wegen der dynamisch-komplexen Herzgeometrie ist die Methode aber auch anfällig für Artefakte insbesondere bei niedrigen
Messschicht. Wegen der dynamisch-komplexen Herzgeometrie ist die Methode aber auch anfällig für Artefakte insbesondere bei niedrigen Eisenkonzentrationen (55).
Eisenkonzentrationen (55). 
 Inzwischen hat sich die Messung von T2* mittels Multi-Echo-Methode in einem Atemintervall als Standard für die Herzeisenbestimmung
Inzwischen hat sich die Messung von T2* mittels Multi-Echo-Methode in einem Atemintervall als Standard für die Herzeisenbestimmung herauskristallisiert (56). Abbildung 7 zeigt dies am Beispiel einer transfundierten Patientin mit b-Thalassaemia major, deren
herauskristallisiert (56). Abbildung 7 zeigt dies am Beispiel einer transfundierten Patientin mit b-Thalassaemia major, deren Lebereisenkonzentration in den letzten 10 Jahren durch entsprechende Chelatordosis-Anpassung auf einem optimalen Wert von ca. 1000
Lebereisenkonzentration in den letzten 10 Jahren durch entsprechende Chelatordosis-Anpassung auf einem optimalen Wert von ca. 1000 µg/gLeber gehalten werden konnte. Allerdings zeigte die Patientin bei normalen echokardiographischen Befunden in den letzten 2 Jahren
µg/gLeber gehalten werden konnte. Allerdings zeigte die Patientin bei normalen echokardiographischen Befunden in den letzten 2 Jahren gelegentlich Extrasystolen im EKG. Bei der Messung von T2* kommt es zunächst auf eine genaue Lokalisation einer Schicht durch die kurze
gelegentlich Extrasystolen im EKG. Bei der Messung von T2* kommt es zunächst auf eine genaue Lokalisation einer Schicht durch die kurze Herzachse in Höhe der Mitte des Papillar-Muskels an (s. Abbildung 4.6). Wegen der Suszeptibilitäts-Artefakte durch Lunge, Leber und Milz sollte
man sich bei der Auswertung der Signal-Intensitäten auf das Septum beschränken (55).
Herzachse in Höhe der Mitte des Papillar-Muskels an (s. Abbildung 4.6). Wegen der Suszeptibilitäts-Artefakte durch Lunge, Leber und Milz sollte
man sich bei der Auswertung der Signal-Intensitäten auf das Septum beschränken (55).  Eine Kalibrierung von Herzeisen-Messungen mittels MRI durch eine quantitative physikalisch-chemische Eisenbestimmung im Herzgewebe steht
noch aus. Im Tierexperiment ist dies für T2 und T2* (57) geschehen. An Patienten mit Eisenüberladung des Herzens konnte das bisher nur
Eine Kalibrierung von Herzeisen-Messungen mittels MRI durch eine quantitative physikalisch-chemische Eisenbestimmung im Herzgewebe steht
noch aus. Im Tierexperiment ist dies für T2 und T2* (57) geschehen. An Patienten mit Eisenüberladung des Herzens konnte das bisher nur histologisch semiquantitativ mittels Endokard-Biopsien für T2 (58) gezeigt werden. An einem Autopsie-Herzen (59) eines Thalassämie-Patienten
histologisch semiquantitativ mittels Endokard-Biopsien für T2 (58) gezeigt werden. An einem Autopsie-Herzen (59) eines Thalassämie-Patienten wurde in einer Myokard-Biopsie des Septums eine Eisenkonzentration von 4.5 mg/g dry weight (ca. 700 µg/gwet wgt) bei einem T2* von 6.9 ms
wurde in einer Myokard-Biopsie des Septums eine Eisenkonzentration von 4.5 mg/g dry weight (ca. 700 µg/gwet wgt) bei einem T2* von 6.9 ms gemessen werden, was mit der Kalibrierung aus dem Tierexperiment relativ gut übereinstimmt.
Eine direktere Bestimmung der Herzeisen-Konzentration ohne die Notwendigkeit einer Kalibrierung mittels chemisch-physikalischer
gemessen werden, was mit der Kalibrierung aus dem Tierexperiment relativ gut übereinstimmt.
Eine direktere Bestimmung der Herzeisen-Konzentration ohne die Notwendigkeit einer Kalibrierung mittels chemisch-physikalischer Eisenmessung in Gewebeproben könnte zukünftig durch die kardio-magnetische Suszeptibilitäts-Messung mit MRI erfolgen (60).
Magnetresonanz-Tomographie von anderen Organen und Geweben
Die fehlende Korrelation der Leber- mit der Herzeisen-Konzentration hat gezeigt, dass die Messung des Lebereisens als alleiniger Indikator für
Eisenmessung in Gewebeproben könnte zukünftig durch die kardio-magnetische Suszeptibilitäts-Messung mit MRI erfolgen (60).
Magnetresonanz-Tomographie von anderen Organen und Geweben
Die fehlende Korrelation der Leber- mit der Herzeisen-Konzentration hat gezeigt, dass die Messung des Lebereisens als alleiniger Indikator für die Erfassung des Komplikationsrisikos durch Eisenüberladung nicht ausreicht. Es kann in bestimmten Organen und Drüsengeweben durch zwar
die Erfassung des Komplikationsrisikos durch Eisenüberladung nicht ausreicht. Es kann in bestimmten Organen und Drüsengeweben durch zwar kleine Eisenmengen zu einer kritischen organ-spezifischen Eisenkonzentration kommen.
Milz
Die Milz kann bei transfundierten Patienten, infolge einer vergrößerten Milz, signifikante Eisenmengen speichern. Im Durchschnitt ist die
kleine Eisenmengen zu einer kritischen organ-spezifischen Eisenkonzentration kommen.
Milz
Die Milz kann bei transfundierten Patienten, infolge einer vergrößerten Milz, signifikante Eisenmengen speichern. Im Durchschnitt ist die Milzeisenkonzentration niedriger als die Lebereisenkonzentration (9), kann aber bei einzelnen Patienten erheblich sein, sodass Änderungen in
Milzeisenkonzentration niedriger als die Lebereisenkonzentration (9), kann aber bei einzelnen Patienten erheblich sein, sodass Änderungen in der Chelatordosis sich in der Leber erst verspätet zeigen. Die Messung der Milzeisenkonzentration ist für Milzvolumina ≥ 400 ml mittels SQUID-
der Chelatordosis sich in der Leber erst verspätet zeigen. Die Messung der Milzeisenkonzentration ist für Milzvolumina ≥ 400 ml mittels SQUID- Biosuszeptometrie möglich und kann die Langzeit-Compliance mit der Chelator-Therapie anzeigen (61).
Hirnanhangsdrüse
Biosuszeptometrie möglich und kann die Langzeit-Compliance mit der Chelator-Therapie anzeigen (61).
Hirnanhangsdrüse  Die vordere Hypophyse scheint am sensitivsten auf frühe toxische Effekte der Eisenüberladung zu reagieren. Dies steht im Zusammenhang mit
Die vordere Hypophyse scheint am sensitivsten auf frühe toxische Effekte der Eisenüberladung zu reagieren. Dies steht im Zusammenhang mit der Beobachtung das 55% der nach 1970 geborenen Thalassämie-Patienten des italienischen Thalassämie-Registers einen Hypogonadismus
der Beobachtung das 55% der nach 1970 geborenen Thalassämie-Patienten des italienischen Thalassämie-Registers einen Hypogonadismus zeigen (5). Die quantitative Messung von Eisen mittels MRI in der relativ kleinen vorderen Hypophyse (200 ± 100 mm3) gestaltet sich als
zeigen (5). Die quantitative Messung von Eisen mittels MRI in der relativ kleinen vorderen Hypophyse (200 ± 100 mm3) gestaltet sich als schwierig. Inwieweit sich die Eisenüberladung der Hypophyse aus der Messung von Ferritin oder dem Lebereisen ableiten lässt, ist eine noch
schwierig. Inwieweit sich die Eisenüberladung der Hypophyse aus der Messung von Ferritin oder dem Lebereisen ableiten lässt, ist eine noch offene Frage, da die bisher eingesetzten MRI-Methoden (SIR) eher als semi-quantitativ bezeichnet werden müssen (62). Ebenso ist der
offene Frage, da die bisher eingesetzten MRI-Methoden (SIR) eher als semi-quantitativ bezeichnet werden müssen (62). Ebenso ist der Zusammenhang zwischen Hypophysen-Funktion (gemessen mit dem Gonadotropin-Test) und einer Eisenüberladung (gemessen mit MRI-T2)
Zusammenhang zwischen Hypophysen-Funktion (gemessen mit dem Gonadotropin-Test) und einer Eisenüberladung (gemessen mit MRI-T2) nicht eindeutig gezeigt (63).
Bauchspeicheldrüse
Eine bei Eisenüberladung häufig anzutreffende Komplikation ist die Glucose-Intoleranz bzw. ein Diabetes mellitus Typ 2, sowohl bei hereditärer
nicht eindeutig gezeigt (63).
Bauchspeicheldrüse
Eine bei Eisenüberladung häufig anzutreffende Komplikation ist die Glucose-Intoleranz bzw. ein Diabetes mellitus Typ 2, sowohl bei hereditärer Hämochromatose als auch bei ß-Thalassaemia major (5, 46). Die Pathogenese des Diabetes im Zusammenhang mit einer Siderose ist nicht
Hämochromatose als auch bei ß-Thalassaemia major (5, 46). Die Pathogenese des Diabetes im Zusammenhang mit einer Siderose ist nicht wirklich verstanden (45, 64). Die Eisenüberladung in der Bauchspeicheldrüse führt zu oxidativem Stress in den Beta-Zellen gefolgt von Zelltod
wirklich verstanden (45, 64). Die Eisenüberladung in der Bauchspeicheldrüse führt zu oxidativem Stress in den Beta-Zellen gefolgt von Zelltod und Glucose-Intoleranz, wobei dieses Szenario allein nicht einen Diabetes zu verursachen scheint (65).
In Patienten mit ß-Thalassamia major wurde mit MRI-T2* ein signifikant höheres Pankreas-zu-Fett SignalVerhältnis als in Normal-Personen
und Glucose-Intoleranz, wobei dieses Szenario allein nicht einen Diabetes zu verursachen scheint (65).
In Patienten mit ß-Thalassamia major wurde mit MRI-T2* ein signifikant höheres Pankreas-zu-Fett SignalVerhältnis als in Normal-Personen gemessen, wobei dieses reziprok mit der Serum-Trypsin-Konzentration korrelierte, was die Autoren mit progressiver Fetteinlagerung als Folge
gemessen, wobei dieses reziprok mit der Serum-Trypsin-Konzentration korrelierte, was die Autoren mit progressiver Fetteinlagerung als Folge der Beta-Zell-Apoptose erklären (66). Signifikante Unterschiede zwischen b-Thalassämie-Patienten mit und ohne Diabetes sind in der
der Beta-Zell-Apoptose erklären (66). Signifikante Unterschiede zwischen b-Thalassämie-Patienten mit und ohne Diabetes sind in der Bauchspeicheldrüse mit MRI-T1–SIR gefunden worden, obgleich diese Ergebnisse durch das Problem der Fetteinlagerung bei progressiver
Bauchspeicheldrüse mit MRI-T1–SIR gefunden worden, obgleich diese Ergebnisse durch das Problem der Fetteinlagerung bei progressiver Pankreasinsuffizienz beeinträchtigt sind.
Andere Drüsen und Gewebe
Die Eiseneinlagerung in andere Organe und Gewebe (Gonaden, Schilddrüse, Gehirn, Niere, Lunge) ist bisher wenig untersucht, wobei den
Pankreasinsuffizienz beeinträchtigt sind.
Andere Drüsen und Gewebe
Die Eiseneinlagerung in andere Organe und Gewebe (Gonaden, Schilddrüse, Gehirn, Niere, Lunge) ist bisher wenig untersucht, wobei den Eisenspeichern im Gehirn bei Sichelzell-Anämien und auch hinsichtlich anderer Krankheiten (Parkinson, Alzheimer) eine besondere Bedeutung
Eisenspeichern im Gehirn bei Sichelzell-Anämien und auch hinsichtlich anderer Krankheiten (Parkinson, Alzheimer) eine besondere Bedeutung zukommt. Eine interessante neuere Methode stellt die Messung der magnetischen Suszeptibilität mit MRI (60) in spezifischen Hirnarealen dar,
zukommt. Eine interessante neuere Methode stellt die Messung der magnetischen Suszeptibilität mit MRI (60) in spezifischen Hirnarealen dar, insbesondere das SWI (= susceptibility weighted imaging), das neben den üblichen Intensitäts-Bildern auch die Phasen-Bilder auswertet (67). Die
Validierung dieser Methoden wird, wie bei der SQUID Biomagnetischen Leber-Suszeptometrie geschehen, ungleich schwieriger werden.
Literatur
37. Fischer R, Engelhardt R, Nielsen P, Gabbe EE, Heinrich HC, Schmiegel WH, Wurbs D. In: Hoke M, Erné SN, Okada YC, Romani GL (Eds.). Advances in
insbesondere das SWI (= susceptibility weighted imaging), das neben den üblichen Intensitäts-Bildern auch die Phasen-Bilder auswertet (67). Die
Validierung dieser Methoden wird, wie bei der SQUID Biomagnetischen Leber-Suszeptometrie geschehen, ungleich schwieriger werden.
Literatur
37. Fischer R, Engelhardt R, Nielsen P, Gabbe EE, Heinrich HC, Schmiegel WH, Wurbs D. In: Hoke M, Erné SN, Okada YC, Romani GL (Eds.). Advances in Biomagnetism '91, Liver iron quantification in the diagnosis and therapy control of iron overload patients. Elsevier, Amsterdam 1992; 585-88
Biomagnetism '91, Liver iron quantification in the diagnosis and therapy control of iron overload patients. Elsevier, Amsterdam 1992; 585-88  38. Ghugre N, Coates TD, Nelson MD, Wood JC. Mechanisms of tissue-iron relaxivity: nuclear magnetic resonance studies of human liver biopsy specimens.
38. Ghugre N, Coates TD, Nelson MD, Wood JC. Mechanisms of tissue-iron relaxivity: nuclear magnetic resonance studies of human liver biopsy specimens. Magn Reson Med 2005; 54:1185-93
Magn Reson Med 2005; 54:1185-93  39. Sheth S, Tang H, Jensen JH, Altmann K, Prakash A, Printz DF, Hordorf AJ, Tosti CL, Azabagic A, Swaminathan S, Brown TR, Olivieri NF, Brittenham GM. MR
39. Sheth S, Tang H, Jensen JH, Altmann K, Prakash A, Printz DF, Hordorf AJ, Tosti CL, Azabagic A, Swaminathan S, Brown TR, Olivieri NF, Brittenham GM. MR measurement of ferritin and hemosiderin iron in patients with iron overload. Ann N Y Acad Sci 2005; 1054:358-78
measurement of ferritin and hemosiderin iron in patients with iron overload. Ann N Y Acad Sci 2005; 1054:358-78  40. Kaltwasser JP, Gottschalk R, Schalk KP, Hartl W. Non-invasive quantitation of liver iron-overload by magnetic resonance imaging. Brit J Haematol 1990;
40. Kaltwasser JP, Gottschalk R, Schalk KP, Hartl W. Non-invasive quantitation of liver iron-overload by magnetic resonance imaging. Brit J Haematol 1990; 74:360-63
74:360-63  41. Engelhardt R, Langkowski JH, Fischer R, Nielsen P, Kooijman H, Heinrich HC, Buecheler E. MRI-sequences for liver iron quantification: studies in aqueous
41. Engelhardt R, Langkowski JH, Fischer R, Nielsen P, Kooijman H, Heinrich HC, Buecheler E. MRI-sequences for liver iron quantification: studies in aqueous iron solutions, iron overloaded rats and patients with hereditary hemochromatosis. Magn Reson Imaging 1994; 12:999-1007
iron solutions, iron overloaded rats and patients with hereditary hemochromatosis. Magn Reson Imaging 1994; 12:999-1007  42. Papakonstantinou OG, Maris TG, Kostaridou V, et al. Assessment of liver iron overload by T2 quantitative magnetic resonance imaging: correlation of T2-
42. Papakonstantinou OG, Maris TG, Kostaridou V, et al. Assessment of liver iron overload by T2 quantitative magnetic resonance imaging: correlation of T2- qMRI measurements with serum ferritin concentration and histologic grading of siderosis. Magn Res Imaging 1995; 13:967-77
qMRI measurements with serum ferritin concentration and histologic grading of siderosis. Magn Res Imaging 1995; 13:967-77  43. St.Pierre TG, Clark PR, Chua-anusorn W, Fleming AJ, Jeffrey GP, Olynyk JK, Pootrakul P, Robins E, Lindeman R. Noninvasive measurement and imaging of
43. St.Pierre TG, Clark PR, Chua-anusorn W, Fleming AJ, Jeffrey GP, Olynyk JK, Pootrakul P, Robins E, Lindeman R. Noninvasive measurement and imaging of liver iron concentrations using proton magnetic resonance. Blood 2005; 105:855-61
liver iron concentrations using proton magnetic resonance. Blood 2005; 105:855-61  44. Wood JC, Enriquez C, Ghugre N, Tyzka JM, Carson S, Nelson MD, Coates TD. MRI R2 and R2* mapping accurately estimates hepatic iron concentration in
44. Wood JC, Enriquez C, Ghugre N, Tyzka JM, Carson S, Nelson MD, Coates TD. MRI R2 and R2* mapping accurately estimates hepatic iron concentration in transfusion-dependent thalassemia and sickle cell disease patients. Blood 2005; 106:1460-65
transfusion-dependent thalassemia and sickle cell disease patients. Blood 2005; 106:1460-65  45. Brittenham GM, Griffith PM, Nienhuis AW, McLaren CE, Young NS, Tucker EE, Allen CJ, Farrell DE , Harris JW. Efficacy of deferoxamine in preventing
45. Brittenham GM, Griffith PM, Nienhuis AW, McLaren CE, Young NS, Tucker EE, Allen CJ, Farrell DE , Harris JW. Efficacy of deferoxamine in preventing complications of iron overload in patients with thalassemia major. N Engl J Med 1994; 331:567-73
complications of iron overload in patients with thalassemia major. N Engl J Med 1994; 331:567-73  46. Strohmeyer G, Niederau C, Stremmel W. Survival and causes of death in hemochromatosis. Observations in 163 patients. Ann N Y Acad Sci 1988; 526:245-
46. Strohmeyer G, Niederau C, Stremmel W. Survival and causes of death in hemochromatosis. Observations in 163 patients. Ann N Y Acad Sci 1988; 526:245- 57
47. Jensen PD, Jensen FT, Christensen T, Heickendorff L, Jensen LG, Ellegaard J. Indirect evidence for the potential ability of magnetic resonance imaging to
57
47. Jensen PD, Jensen FT, Christensen T, Heickendorff L, Jensen LG, Ellegaard J. Indirect evidence for the potential ability of magnetic resonance imaging to evaluate the myocardial iron content in patients with transfusional iron overload. MAGMA 2001; 12:153-66
evaluate the myocardial iron content in patients with transfusional iron overload. MAGMA 2001; 12:153-66  48. Anderson LJ, Wonke B, Prescott E, Holden S, Walker JM, Pennell DJ. Comparison of effects of oral deferiprone and subcutaneous desferrioxamine on
48. Anderson LJ, Wonke B, Prescott E, Holden S, Walker JM, Pennell DJ. Comparison of effects of oral deferiprone and subcutaneous desferrioxamine on myocardial iron concentrations and ventricular function in beta-thalassaemia. Lancet 2002; 360(9332):516-20
myocardial iron concentrations and ventricular function in beta-thalassaemia. Lancet 2002; 360(9332):516-20  49. Pennell DJ, Berdoukas V, Karagiorga M, Ladis V, Piga A, Aessopos A, Gotsis ED, Tanner MA, Smith GC, Westwood MA, Wonke B, Galanello R. Randomized
49. Pennell DJ, Berdoukas V, Karagiorga M, Ladis V, Piga A, Aessopos A, Gotsis ED, Tanner MA, Smith GC, Westwood MA, Wonke B, Galanello R. Randomized controlled trial of deferiprone or deferoxamine in beta-thalassemia major patients with asymptomatic myocardial siderosis. Blood 2005; 107:3738-3744
controlled trial of deferiprone or deferoxamine in beta-thalassemia major patients with asymptomatic myocardial siderosis. Blood 2005; 107:3738-3744  50. Fitchett DH, Coltart DJ, Littler WA, Leyland MJ, Trueman T, Gozzard DI, Peters TJ. Cardiac involvement in secondary haemochromatosis: a catheter biopsy
50. Fitchett DH, Coltart DJ, Littler WA, Leyland MJ, Trueman T, Gozzard DI, Peters TJ. Cardiac involvement in secondary haemochromatosis: a catheter biopsy study and analysis of myocardium. Cardiovasc Res 1980; 14:719-24
study and analysis of myocardium. Cardiovasc Res 1980; 14:719-24  51. Barosi O, Arbustini E, Gavazzi A, Grasso M, Pucci A. Myocardial iron grading by endomyocardial biopsy. A clinico-pathologic study on iron overloaded
51. Barosi O, Arbustini E, Gavazzi A, Grasso M, Pucci A. Myocardial iron grading by endomyocardial biopsy. A clinico-pathologic study on iron overloaded patients. Eur J Haematol 1989; 42:382-88
patients. Eur J Haematol 1989; 42:382-88  52. Buja LM, Roberts WC. Iron in the heart. Etiology and clinical significance. Am J Med 1971; 51:209-21
52. Buja LM, Roberts WC. Iron in the heart. Etiology and clinical significance. Am J Med 1971; 51:209-21  53. Olson LJ, Edwards WD, McCall JT, Ilstrup DM, Gersh BJ. Cardiac iron deposition in idiopathic hemochromatosis: histologic and analytic assessment of 14
53. Olson LJ, Edwards WD, McCall JT, Ilstrup DM, Gersh BJ. Cardiac iron deposition in idiopathic hemochromatosis: histologic and analytic assessment of 14 hearts from autopsy. J Am Coll Cardiol 1987; 10:1239-43
hearts from autopsy. J Am Coll Cardiol 1987; 10:1239-43  54. Sonakul D, Thakerngpol K, Pacharee P. Cardiac pathology in 76 thalassemic patients. Birth Defects Orig Artic Ser 1988; 23:177-91
54. Sonakul D, Thakerngpol K, Pacharee P. Cardiac pathology in 76 thalassemic patients. Birth Defects Orig Artic Ser 1988; 23:177-91  55. Ghugre NR, Enriquez CM, Coates TD, Nelson MD Jr, Wood JC. Improved R2* measurements in myocardial iron overload. J Magn Reson Imaging 2006; 23:9-
55. Ghugre NR, Enriquez CM, Coates TD, Nelson MD Jr, Wood JC. Improved R2* measurements in myocardial iron overload. J Magn Reson Imaging 2006; 23:9- 16
56. Westwood M, Anderson LJ, Firmin DN, Gatehouse PD Charrier CC, Wonke B, Pennell DJ. A single breath-hold multiecho T2* cardiovascular magnetic
16
56. Westwood M, Anderson LJ, Firmin DN, Gatehouse PD Charrier CC, Wonke B, Pennell DJ. A single breath-hold multiecho T2* cardiovascular magnetic resonance technique for diagnosis of myocardial iron overload. J Mag Reson Imag 2003; 18:33-39
resonance technique for diagnosis of myocardial iron overload. J Mag Reson Imag 2003; 18:33-39  57. Wood JC, Otto-Duessel M, Aguilar M, Nick H, Nelson MD, Coates TD, Pollack H, Moats R. Cardiac iron determines cardiac T2*, T2, and T1 in the gerbil
57. Wood JC, Otto-Duessel M, Aguilar M, Nick H, Nelson MD, Coates TD, Pollack H, Moats R. Cardiac iron determines cardiac T2*, T2, and T1 in the gerbil model of iron cardiomyopathy. Circulation 2005; 112:535-43
model of iron cardiomyopathy. Circulation 2005; 112:535-43  58. Mavrogeni SI, Markussis V, Kaklamanis L, Tsiapras D, Paraskevaidis I, Karavolias G, Karagiorga M, Douskou M, Cokkinos DV, Kremastinos DT. A comparison
58. Mavrogeni SI, Markussis V, Kaklamanis L, Tsiapras D, Paraskevaidis I, Karavolias G, Karagiorga M, Douskou M, Cokkinos DV, Kremastinos DT. A comparison of magnetic resonance imaging and cardiac biopsy in the evaluation of heart iron overload in patients with beta-thalassemia major. Eur J Haematol 2005;
of magnetic resonance imaging and cardiac biopsy in the evaluation of heart iron overload in patients with beta-thalassemia major. Eur J Haematol 2005; 75:241-47
75:241-47  59. Westwood MA, Sheppard MN, Awogbade M, Ellis G, Stephens AD, Pennell DJ. Myocardial biopsy and T2* magnetic resonance in heart failure due to
59. Westwood MA, Sheppard MN, Awogbade M, Ellis G, Stephens AD, Pennell DJ. Myocardial biopsy and T2* magnetic resonance in heart failure due to thalassaemia. Brit J Haematol 2004; 128:2
thalassaemia. Brit J Haematol 2004; 128:2  60. Wang ZJ, Lian L, Chen Q, Asakura T, Zhao H, Cohen AR. 1/T2 and magnetic susceptibility measurements in a gerbil cardiac iron overload model. Radiology
60. Wang ZJ, Lian L, Chen Q, Asakura T, Zhao H, Cohen AR. 1/T2 and magnetic susceptibility measurements in a gerbil cardiac iron overload model. Radiology 2005; 234:749-55
2005; 234:749-55  61. Fischer R. Liver iron susceptometry. In: Andrä W, Nowak H (Eds.). Magnetism in Medicine - a Handbook. Wiley-VCH , Berlin 1998; 286-301
61. Fischer R. Liver iron susceptometry. In: Andrä W, Nowak H (Eds.). Magnetism in Medicine - a Handbook. Wiley-VCH , Berlin 1998; 286-301  62. Argyropoulou MI, Kiortsis DN, Efremidis SC. MRI of the liver and the pituitary gland in patients with beta-thalassemia major: does hepatic siderosis
62. Argyropoulou MI, Kiortsis DN, Efremidis SC. MRI of the liver and the pituitary gland in patients with beta-thalassemia major: does hepatic siderosis predict pituitary iron deposition? Eur Radiol 2003;13:12-6
predict pituitary iron deposition? Eur Radiol 2003;13:12-6  63. Berkovitch M, Bistritzer T, Milone SD, Perlman K, Kucharczyk W, Olivieri NF. Iron deposition in the anterior pituitary in homozygous beta-thalassemia: MRI
63. Berkovitch M, Bistritzer T, Milone SD, Perlman K, Kucharczyk W, Olivieri NF. Iron deposition in the anterior pituitary in homozygous beta-thalassemia: MRI evaluation and correlation with gonadal function. J Pediatr Endocrinol Metab 2000; 13:179-84
evaluation and correlation with gonadal function. J Pediatr Endocrinol Metab 2000; 13:179-84  64. Cario H, Holl RW, Debatin KM, Kohne E. Insulin sensitivity and beta-cell secretion in thalassaemia major with secondary haemochromatosis: assessment
64. Cario H, Holl RW, Debatin KM, Kohne E. Insulin sensitivity and beta-cell secretion in thalassaemia major with secondary haemochromatosis: assessment by oral glucose tolerance test. Eur J Pediatr 2003; 162:139-46
by oral glucose tolerance test. Eur J Pediatr 2003; 162:139-46  65. Cooksey RC, Jouihan HA, Ajioka RS, Hazel MW, Jones DL, Kushner JP, McClain DA. Oxidative stress, beta-cell apoptosis, and decreased insulin secretory
65. Cooksey RC, Jouihan HA, Ajioka RS, Hazel MW, Jones DL, Kushner JP, McClain DA. Oxidative stress, beta-cell apoptosis, and decreased insulin secretory capacity in mouse models of hemochromatosis. Endocrinology 2004; 145:5305-12
capacity in mouse models of hemochromatosis. Endocrinology 2004; 145:5305-12  66. Midiri M, Lo Casto A, Sparacia G, D’Angelo, P, Malizia R, Finazzo M, Montalto G, Solbiati L, Lagalla R, De Maria M. MR imaging of pancreatic changes in
66. Midiri M, Lo Casto A, Sparacia G, D’Angelo, P, Malizia R, Finazzo M, Montalto G, Solbiati L, Lagalla R, De Maria M. MR imaging of pancreatic changes in patients with transfusion dependent b-thalassemia major. Am J Roentgenol 1999; 173:187-92
patients with transfusion dependent b-thalassemia major. Am J Roentgenol 1999; 173:187-92  67. Haacke EM, Cheng NY, House MJ, Liu Q, Neelavalli J, Ogg RJ, Khan A, Ayaz M, Kirsch W, Obenaus A. Imaging iron stores in the brain using magnetic
67. Haacke EM, Cheng NY, House MJ, Liu Q, Neelavalli J, Ogg RJ, Khan A, Ayaz M, Kirsch W, Obenaus A. Imaging iron stores in the brain using magnetic resonance imaging. Magn Reson Imaging 2005; 23:1-25
resonance imaging. Magn Reson Imaging 2005; 23:1-25 

 Geräts von der Kern-Magnetisierung M(r) aller Protonen im jeweiligen Volumenelement dV des Körpers, der Detektor-Konfiguration und dem
Geräts von der Kern-Magnetisierung M(r) aller Protonen im jeweiligen Volumenelement dV des Körpers, der Detektor-Konfiguration und dem Abstand r zur Detektorspule bestimmt. Anders als bei der Suszeptometrie gibt es jedoch nach heutigem Kenntnisstand keine befriedigende
Abstand r zur Detektorspule bestimmt. Anders als bei der Suszeptometrie gibt es jedoch nach heutigem Kenntnisstand keine befriedigende quantitative Theorie für die Wechselwirkung von Eisenatomen mit der Kernmagnetisierung der Protonen (38). und für die daraus resultierende
quantitative Theorie für die Wechselwirkung von Eisenatomen mit der Kernmagnetisierung der Protonen (38). und für die daraus resultierende longitudinale und transversale Relaxation (R1 = 1/T1 und R2 = 1/T2). Darüber hinaus wird die Wechselwirkung der Protonen mit einem
longitudinale und transversale Relaxation (R1 = 1/T1 und R2 = 1/T2). Darüber hinaus wird die Wechselwirkung der Protonen mit einem magnetischen Zentrum von einer Reihe von Parametern beeinflusst wie der Zahl der Protonen-Liganden, ihrer Beweglichkeit (correlation time),
der Größe der Ferritin- und Hämosiderin-Molekül-Cluster, unterschiedliche Protonen-Pools, etc. Diese komplexen Zusammenhänge eröffnen
magnetischen Zentrum von einer Reihe von Parametern beeinflusst wie der Zahl der Protonen-Liganden, ihrer Beweglichkeit (correlation time),
der Größe der Ferritin- und Hämosiderin-Molekül-Cluster, unterschiedliche Protonen-Pools, etc. Diese komplexen Zusammenhänge eröffnen andererseits auch die Möglichkeit zusätzliche Informationen über Hämosiderin- und Ferritin-Eisenverteilung zu erhalten (39). Die eisen-
andererseits auch die Möglichkeit zusätzliche Informationen über Hämosiderin- und Ferritin-Eisenverteilung zu erhalten (39). Die eisen- spezifische in vivo MR-Tomographie von 57Fe ist wegen der sehr kleinen Sensitivität (1H : 57Fe = 1 : 10-5) und der z. Zt. erreichbaren
spezifische in vivo MR-Tomographie von 57Fe ist wegen der sehr kleinen Sensitivität (1H : 57Fe = 1 : 10-5) und der z. Zt. erreichbaren Magnetfeldstärken nicht möglich.
Trotz aller Komplexität bietet die quantitative MRI-Eisenbestimmung auch eine Reihe von Vorteilen, wenn die nötige Expertise vorhanden ist.
Magnetfeldstärken nicht möglich.
Trotz aller Komplexität bietet die quantitative MRI-Eisenbestimmung auch eine Reihe von Vorteilen, wenn die nötige Expertise vorhanden ist. Diese beruhen hauptsächlich auf der 3-dimensionalen Lokalisation (Bildgebung) und der Erfassung von tiefliegenden Organregionen. Seit Mitte
Diese beruhen hauptsächlich auf der 3-dimensionalen Lokalisation (Bildgebung) und der Erfassung von tiefliegenden Organregionen. Seit Mitte der 90er Jahre haben sich verschiedene MRI-Methoden zur Erfassung des Lebereisens herauskristallisiert, die laufend eine Verbesserung durch
der 90er Jahre haben sich verschiedene MRI-Methoden zur Erfassung des Lebereisens herauskristallisiert, die laufend eine Verbesserung durch homogenere Magnetfelder und kürzere Echozeiten erfahren haben. Es soll hier nur auf die Single-Spin-Echo Methode (SSE) zur Bestimmung der
homogenere Magnetfelder und kürzere Echozeiten erfahren haben. Es soll hier nur auf die Single-Spin-Echo Methode (SSE) zur Bestimmung der transversalen Relaxationszeit T2 eingegangen werden (40-42), die heute als anerkanntes quantitatives Verfahren zur Lebereisenbestimmung
transversalen Relaxationszeit T2 eingegangen werden (40-42), die heute als anerkanntes quantitatives Verfahren zur Lebereisenbestimmung und seiner 2-dimensionalen Verteilung (liver iron imaging) mit standardisiertem Messprotokoll und zentraler Analyse (Ferriscan®) weltweit zur
und seiner 2-dimensionalen Verteilung (liver iron imaging) mit standardisiertem Messprotokoll und zentraler Analyse (Ferriscan®) weltweit zur Verfügung steht (43).
Bei dem Spin-Echo Verfahren klingen die in der Detektorspule empfangenen Radiowellen-Signal-Intensitäten SI der Echos, die durch
Verfügung steht (43).
Bei dem Spin-Echo Verfahren klingen die in der Detektorspule empfangenen Radiowellen-Signal-Intensitäten SI der Echos, die durch Anregungsimpulse im Abstand einer gewählten Echozeit TE erzeugt werden, exponentiell mit der transversalen oder Spin-Spin-Relaxationszeit
Anregungsimpulse im Abstand einer gewählten Echozeit TE erzeugt werden, exponentiell mit der transversalen oder Spin-Spin-Relaxationszeit T2 ab. In erster Näherung gilt die Gleichung 4 mit den neben T2 zu bestimmenden Signalintensitäten SI bei TE = 0 und bei TE → ∞.
T2 ab. In erster Näherung gilt die Gleichung 4 mit den neben T2 zu bestimmenden Signalintensitäten SI bei TE = 0 und bei TE → ∞.  (4)
SI (TE) = SIo · EXP(-TE/T2) + SI∞
(4)
SI (TE) = SIo · EXP(-TE/T2) + SI∞ (transversale Relaxation)
(transversale Relaxation)  Bei der SSE-Methode wird nur das qualitativ beste 1. Echo registriert und die Echozeit wird variiert. Die Funktion 4.4 wird an die resultierenden
Bei der SSE-Methode wird nur das qualitativ beste 1. Echo registriert und die Echozeit wird variiert. Die Funktion 4.4 wird an die resultierenden Signal-Intensitäten angepasst. Bei Vorhandensein von mehreren Protonenpools mit unterschiedlichem Relaxationsverhalten muss die mono-
Signal-Intensitäten angepasst. Bei Vorhandensein von mehreren Protonenpools mit unterschiedlichem Relaxationsverhalten muss die mono- exponentielle Funktion 4 zu einer bi- oder multi-exponentiellen Funktion erweitert werden (43). Ob ein bi-exponentielles Modell für die Leber
wirklich bessere Resultate liefert oder angesichts der verwendeten Echozeiten und dem z. Zt. erreichbaren Signal-Rausch-Verhältnis der MRI-
exponentielle Funktion 4 zu einer bi- oder multi-exponentiellen Funktion erweitert werden (43). Ob ein bi-exponentielles Modell für die Leber
wirklich bessere Resultate liefert oder angesichts der verwendeten Echozeiten und dem z. Zt. erreichbaren Signal-Rausch-Verhältnis der MRI- Tomographen überstrapaziert zu sein scheint, müssen zukünftige Forschungen zeigen (44).
Abb. 5: Eisenverteilung in einer 5 mm Leberschicht eines Patienten mit HbE/b-Thalassämie (29 y, HCV+) (1.5 T Philips Intera Gyroscan®, CHRCO-
Tomographen überstrapaziert zu sein scheint, müssen zukünftige Forschungen zeigen (44).
Abb. 5: Eisenverteilung in einer 5 mm Leberschicht eines Patienten mit HbE/b-Thalassämie (29 y, HCV+) (1.5 T Philips Intera Gyroscan®, CHRCO- Oakland, USA) mit einer durchschnittlichen Lebereisen-Konzentration von 18.6 mg/gdry wgt (Ferriscan®). Die transversale Relaxation R2 pro
Oakland, USA) mit einer durchschnittlichen Lebereisen-Konzentration von 18.6 mg/gdry wgt (Ferriscan®). Die transversale Relaxation R2 pro Volumenelement und somit die Eisenverteilung variiert von 6.0 mg/gdry wgt (rot: R2 ≥ 92 s-1) bis 30.5 mg/gdry wgt (gelb: R2 280 ≤ s-1).
Volumenelement und somit die Eisenverteilung variiert von 6.0 mg/gdry wgt (rot: R2 ≥ 92 s-1) bis 30.5 mg/gdry wgt (gelb: R2 280 ≤ s-1). 
 In Abbildung 5 ist die SSE-Methode mittels Ferriscan®-Analyse (43) exemplarisch für einen transfundierten Patienten mit HbE/b-Thalassämie
In Abbildung 5 ist die SSE-Methode mittels Ferriscan®-Analyse (43) exemplarisch für einen transfundierten Patienten mit HbE/b-Thalassämie gezeigt, bei dem aufgrund klinischer Daten (Ferritin: 6600 µg/l, ALT: 200 U/l, Transfusion: 100 ml/kg/Jahr Deferoxamin-Chelatordosis: 10
gezeigt, bei dem aufgrund klinischer Daten (Ferritin: 6600 µg/l, ALT: 200 U/l, Transfusion: 100 ml/kg/Jahr Deferoxamin-Chelatordosis: 10 mg/kg/d) der Verdacht bestand, dass das Lebereisen durch SQUID-BLS (LIC ≈ 11.3 mg/gdry wgt) unterrepräsentiert würde. Die exponentielle
mg/kg/d) der Verdacht bestand, dass das Lebereisen durch SQUID-BLS (LIC ≈ 11.3 mg/gdry wgt) unterrepräsentiert würde. Die exponentielle Modell-Funktion zur Ermittlung der transversalen Relaxationen R2 wird an die gemittelten Signalintensitäten pro Volumenelement (ca. 10 mm3)
in Abhängigkeit von den Echozeiten angepasst (A1 ... An). Daraus wird dann für eine repräsentative Leberschicht das R2-Bild berechnet und
Modell-Funktion zur Ermittlung der transversalen Relaxationen R2 wird an die gemittelten Signalintensitäten pro Volumenelement (ca. 10 mm3)
in Abhängigkeit von den Echozeiten angepasst (A1 ... An). Daraus wird dann für eine repräsentative Leberschicht das R2-Bild berechnet und dargestellt (B). Aus dem R2-Histogramm (C) wird dann mittels nicht-linearer Kalibrierkurve (D), die zuvor aus den gefriergetrockneten
dargestellt (B). Aus dem R2-Histogramm (C) wird dann mittels nicht-linearer Kalibrierkurve (D), die zuvor aus den gefriergetrockneten Leberbiopsien von 105 Patienten mit b-Thalassämie, hereditärer Hämochromatose und von HCV infizierten Patienten erstellt worden ist (43),
Leberbiopsien von 105 Patienten mit b-Thalassämie, hereditärer Hämochromatose und von HCV infizierten Patienten erstellt worden ist (43),  die mittlere Lebereisenkonzentration berechnet.
Herzeisenquantifizierung
Auch wenn die Hauptmenge an Eisen bei Eisenüberladungs-Krankheiten in der Leber akkumuliert wird, kann es auch in anderen Organen zu
die mittlere Lebereisenkonzentration berechnet.
Herzeisenquantifizierung
Auch wenn die Hauptmenge an Eisen bei Eisenüberladungs-Krankheiten in der Leber akkumuliert wird, kann es auch in anderen Organen zu kritischen Eisenkonzentrationen kommen, was klinisch viel größere Beedeutng haben kann.. Insbesondere bei Transfusions-Siderosen sind
kritischen Eisenkonzentrationen kommen, was klinisch viel größere Beedeutng haben kann.. Insbesondere bei Transfusions-Siderosen sind lebensbedrohliche Kardiomyopathien und Herzrhythmusstörungen mit einer Eisenüberladung des Herzens in Verbindung gebracht worden (45),
während Herzprobleme bei hereditärer Hämochromatose eher selten vorkommen (46). In einer der repräsentativsten Studien zum Überleben
lebensbedrohliche Kardiomyopathien und Herzrhythmusstörungen mit einer Eisenüberladung des Herzens in Verbindung gebracht worden (45),
während Herzprobleme bei hereditärer Hämochromatose eher selten vorkommen (46). In einer der repräsentativsten Studien zum Überleben von 1146 Patienten mit b-Thalassaemia major, die zwischen 1960 und 1987 geboren worden sind, wurde Herzversagen als häufigste
von 1146 Patienten mit b-Thalassaemia major, die zwischen 1960 und 1987 geboren worden sind, wurde Herzversagen als häufigste Todesursache (60 %) gefunden (5). Diese Überlebensstudien und die Erfolge der Intensiv-Chelatorbehandlung bei Herzproblemen führten zu der
Vorstellung, dass Patienten mit optimalen Eisenspeichern und an die Bluttransfusions-Rate angepasstem Chelator-Regime ein geringes Risiko für
Herzprobleme zu erwarten hätten (27).
In den letzten Jahren wurden jedoch neuere Befunde erhoben, die bei ß-Thalassaemia major keinen Zusammenhang zwischen der Häufigkeit
Todesursache (60 %) gefunden (5). Diese Überlebensstudien und die Erfolge der Intensiv-Chelatorbehandlung bei Herzproblemen führten zu der
Vorstellung, dass Patienten mit optimalen Eisenspeichern und an die Bluttransfusions-Rate angepasstem Chelator-Regime ein geringes Risiko für
Herzprobleme zu erwarten hätten (27).
In den letzten Jahren wurden jedoch neuere Befunde erhoben, die bei ß-Thalassaemia major keinen Zusammenhang zwischen der Häufigkeit von Herzproblemen und erhöhten Eisenspeicher-Parametern wie Ferritin und Lebereisenkonzentration aufzeigen. Mit einer neuen MRI-T2*-
von Herzproblemen und erhöhten Eisenspeicher-Parametern wie Ferritin und Lebereisenkonzentration aufzeigen. Mit einer neuen MRI-T2*- Methode wurde diese scheinbar paradoxe Situation direkt bestätigt, indem kurze T2*-Relaxationszeiten (mehr Eisen) auch im Herzen von gut
Methode wurde diese scheinbar paradoxe Situation direkt bestätigt, indem kurze T2*-Relaxationszeiten (mehr Eisen) auch im Herzen von gut chelierten Patienten mit niedrigem LIC gefunden wurden (8). Im Gegensatz dazu wurde in Studien an MDS-Patienten mit mehr klassischen MRI-
chelierten Patienten mit niedrigem LIC gefunden wurden (8). Im Gegensatz dazu wurde in Studien an MDS-Patienten mit mehr klassischen MRI- Methoden (spin-echo T2, SIR = signal intensity ratio) eine signifikante Korrelation zwischen MRI-Parametern im Herzen und LIC bzw. Ferritin
Methoden (spin-echo T2, SIR = signal intensity ratio) eine signifikante Korrelation zwischen MRI-Parametern im Herzen und LIC bzw. Ferritin gefunden (47).
Aktuell finden quantitative MRI-T2*-Herz-Messungen im Zusammenhang mit der klinischen Testung von neuen oralen Eisenchelatoren
gefunden (47).
Aktuell finden quantitative MRI-T2*-Herz-Messungen im Zusammenhang mit der klinischen Testung von neuen oralen Eisenchelatoren (Deferipron, Deferasirox) oder Chelator-Kombinationen (Deferoxamin & Deferipron) große Beachtung, da es möglicherweise Unterschiede in
(Deferipron, Deferasirox) oder Chelator-Kombinationen (Deferoxamin & Deferipron) große Beachtung, da es möglicherweise Unterschiede in der Effizienz von verschiedenen Chelatoren gibt, das klinisch offenbar bedeutsame Speichereisen im Herzen zu entfernen (48, 49).
Autopsie- und Endokard-Biopsie
Im Gegensatz zur Leber wird die direkte physikalisch-chemische Bestimmung der Herzeisen-Konzentration (HIC = heart iron concentration) in
der Effizienz von verschiedenen Chelatoren gibt, das klinisch offenbar bedeutsame Speichereisen im Herzen zu entfernen (48, 49).
Autopsie- und Endokard-Biopsie
Im Gegensatz zur Leber wird die direkte physikalisch-chemische Bestimmung der Herzeisen-Konzentration (HIC = heart iron concentration) in einer Katheter-Biopsie eher selten durchgeführt und ist wegen der Inhomogenität der Eisenverteilung im Myokard-Gewebe auch nicht
einer Katheter-Biopsie eher selten durchgeführt und ist wegen der Inhomogenität der Eisenverteilung im Myokard-Gewebe auch nicht repräsentativ für das gesamte Herzeisen (50, 51).
repräsentativ für das gesamte Herzeisen (50, 51).  In Autopsie-Herzen mit signifikanter histologischer Eisenfärbung haben Buja und Roberts (52) HIC-Werte zwischen 160 und 1470 µg-Fe/gwet
In Autopsie-Herzen mit signifikanter histologischer Eisenfärbung haben Buja und Roberts (52) HIC-Werte zwischen 160 und 1470 µg-Fe/gwet weigt gefunden. Von Interesse für nicht-invasive Methoden dürfte auch das relativ hohe Feucht-zu-Trockengewichts-Verhältnis von 6.5 ± 0.6
weigt gefunden. Von Interesse für nicht-invasive Methoden dürfte auch das relativ hohe Feucht-zu-Trockengewichts-Verhältnis von 6.5 ± 0.6 sein. Alle Patienten mit HIC > 600 µg-Fe/gwet weigt von mehr als 23 g transfundierten Eisen hatten eine Herzinsuffizienz entwickelt. Außerdem
sein. Alle Patienten mit HIC > 600 µg-Fe/gwet weigt von mehr als 23 g transfundierten Eisen hatten eine Herzinsuffizienz entwickelt. Außerdem wurde ein Eisengradient im Myokard mit mehr Eisen im Epikard beobachtet. In Autopsie-Herzen von Patienten mit hereditärer
wurde ein Eisengradient im Myokard mit mehr Eisen im Epikard beobachtet. In Autopsie-Herzen von Patienten mit hereditärer Hämochromatose wurden HIC-Werte > 500 µg-Fe/gwet weigt (normal: 20 - 125µg-Fe/gwet weigt) im gesamten links-ventrikulären Herzmuskel
Hämochromatose wurden HIC-Werte > 500 µg-Fe/gwet weigt (normal: 20 - 125µg-Fe/gwet weigt) im gesamten links-ventrikulären Herzmuskel und im Septum gefunden (53). In einer anderen Autopsie-Studie in Patienten mit HbE/b-Thalassämie, die an kardialer Hypertrophie litten,
und im Septum gefunden (53). In einer anderen Autopsie-Studie in Patienten mit HbE/b-Thalassämie, die an kardialer Hypertrophie litten, waren in Histologie-Schnitten nur leichte Eisenfärbungen sichtbar (54).
Quantitative Magnetresonanz-Tomographie des Herzens
waren in Histologie-Schnitten nur leichte Eisenfärbungen sichtbar (54).
Quantitative Magnetresonanz-Tomographie des Herzens  Von allen nicht-invasiven Methoden zur Messung des Herzeisens erscheint zur Zeit die Magnetresonanz-Tomographie am vielversprechendsten
Von allen nicht-invasiven Methoden zur Messung des Herzeisens erscheint zur Zeit die Magnetresonanz-Tomographie am vielversprechendsten zu sein (47). Insbesondere ist die MRI-T2*-Methode für die Messung der vergleichsweise niedrigen Herzeisen-Konzentration (s. Kap. 4.3.1)
zu sein (47). Insbesondere ist die MRI-T2*-Methode für die Messung der vergleichsweise niedrigen Herzeisen-Konzentration (s. Kap. 4.3.1) sensitiver als die mehr klassischen MRI-Methoden (T2, SIR). Die transversale „magnetische“ Relaxation R2* = 1/T2* kennzeichnet den Zerfall der
sensitiver als die mehr klassischen MRI-Methoden (T2, SIR). Die transversale „magnetische“ Relaxation R2* = 1/T2* kennzeichnet den Zerfall der Protonenresonanz in der Umgebung lokaler Magnetfelder (Suszeptibilitäts-Effekte). Sie ist in erster Näherung der Summeneffekt aus der
Protonenresonanz in der Umgebung lokaler Magnetfelder (Suszeptibilitäts-Effekte). Sie ist in erster Näherung der Summeneffekt aus der transversalen Relaxation 1/T2, die die Wechselwirkung mit den Kernspins der Nachbarprotonen kennzeichnet, und der Wechselwirkung mit den
umgebenden Magnetfeld-Inhomogenitäten (nicht-rephasierende technische Eigenschaften und/oder lokale magnetische Momente von
transversalen Relaxation 1/T2, die die Wechselwirkung mit den Kernspins der Nachbarprotonen kennzeichnet, und der Wechselwirkung mit den
umgebenden Magnetfeld-Inhomogenitäten (nicht-rephasierende technische Eigenschaften und/oder lokale magnetische Momente von Nachbaratomen) (Gleichung 4.5) (19).
(4.5)
R2* = 1/T2* = 1/T2 + 1/T’(transversale „magnetische“ Relaxationszeit T2*)
Nachbaratomen) (Gleichung 4.5) (19).
(4.5)
R2* = 1/T2* = 1/T2 + 1/T’(transversale „magnetische“ Relaxationszeit T2*)  Um die relativ kleinen magnetischen Suszeptibilitätseffekte der Nachbaratome genügend präzise zu messen (T2* < T2), erfordert diese Methode
Um die relativ kleinen magnetischen Suszeptibilitätseffekte der Nachbaratome genügend präzise zu messen (T2* < T2), erfordert diese Methode allerdings sehr homogene Magnetfelder ≥ 1.5 Tesla im Beobachtungsfenster, kurze Echozeiten (TE < 3 ms) und die Lokalisation einer optimalen
allerdings sehr homogene Magnetfelder ≥ 1.5 Tesla im Beobachtungsfenster, kurze Echozeiten (TE < 3 ms) und die Lokalisation einer optimalen Messschicht. Wegen der dynamisch-komplexen Herzgeometrie ist die Methode aber auch anfällig für Artefakte insbesondere bei niedrigen
Messschicht. Wegen der dynamisch-komplexen Herzgeometrie ist die Methode aber auch anfällig für Artefakte insbesondere bei niedrigen Eisenkonzentrationen (55).
Eisenkonzentrationen (55). 
 Inzwischen hat sich die Messung von T2* mittels Multi-Echo-Methode in einem Atemintervall als Standard für die Herzeisenbestimmung
Inzwischen hat sich die Messung von T2* mittels Multi-Echo-Methode in einem Atemintervall als Standard für die Herzeisenbestimmung herauskristallisiert (56). Abbildung 7 zeigt dies am Beispiel einer transfundierten Patientin mit b-Thalassaemia major, deren
herauskristallisiert (56). Abbildung 7 zeigt dies am Beispiel einer transfundierten Patientin mit b-Thalassaemia major, deren Lebereisenkonzentration in den letzten 10 Jahren durch entsprechende Chelatordosis-Anpassung auf einem optimalen Wert von ca. 1000
Lebereisenkonzentration in den letzten 10 Jahren durch entsprechende Chelatordosis-Anpassung auf einem optimalen Wert von ca. 1000 µg/gLeber gehalten werden konnte. Allerdings zeigte die Patientin bei normalen echokardiographischen Befunden in den letzten 2 Jahren
µg/gLeber gehalten werden konnte. Allerdings zeigte die Patientin bei normalen echokardiographischen Befunden in den letzten 2 Jahren gelegentlich Extrasystolen im EKG. Bei der Messung von T2* kommt es zunächst auf eine genaue Lokalisation einer Schicht durch die kurze
gelegentlich Extrasystolen im EKG. Bei der Messung von T2* kommt es zunächst auf eine genaue Lokalisation einer Schicht durch die kurze Herzachse in Höhe der Mitte des Papillar-Muskels an (s. Abbildung 4.6). Wegen der Suszeptibilitäts-Artefakte durch Lunge, Leber und Milz sollte
man sich bei der Auswertung der Signal-Intensitäten auf das Septum beschränken (55).
Herzachse in Höhe der Mitte des Papillar-Muskels an (s. Abbildung 4.6). Wegen der Suszeptibilitäts-Artefakte durch Lunge, Leber und Milz sollte
man sich bei der Auswertung der Signal-Intensitäten auf das Septum beschränken (55).  Eine Kalibrierung von Herzeisen-Messungen mittels MRI durch eine quantitative physikalisch-chemische Eisenbestimmung im Herzgewebe steht
noch aus. Im Tierexperiment ist dies für T2 und T2* (57) geschehen. An Patienten mit Eisenüberladung des Herzens konnte das bisher nur
Eine Kalibrierung von Herzeisen-Messungen mittels MRI durch eine quantitative physikalisch-chemische Eisenbestimmung im Herzgewebe steht
noch aus. Im Tierexperiment ist dies für T2 und T2* (57) geschehen. An Patienten mit Eisenüberladung des Herzens konnte das bisher nur histologisch semiquantitativ mittels Endokard-Biopsien für T2 (58) gezeigt werden. An einem Autopsie-Herzen (59) eines Thalassämie-Patienten
histologisch semiquantitativ mittels Endokard-Biopsien für T2 (58) gezeigt werden. An einem Autopsie-Herzen (59) eines Thalassämie-Patienten wurde in einer Myokard-Biopsie des Septums eine Eisenkonzentration von 4.5 mg/g dry weight (ca. 700 µg/gwet wgt) bei einem T2* von 6.9 ms
wurde in einer Myokard-Biopsie des Septums eine Eisenkonzentration von 4.5 mg/g dry weight (ca. 700 µg/gwet wgt) bei einem T2* von 6.9 ms gemessen werden, was mit der Kalibrierung aus dem Tierexperiment relativ gut übereinstimmt.
Eine direktere Bestimmung der Herzeisen-Konzentration ohne die Notwendigkeit einer Kalibrierung mittels chemisch-physikalischer
gemessen werden, was mit der Kalibrierung aus dem Tierexperiment relativ gut übereinstimmt.
Eine direktere Bestimmung der Herzeisen-Konzentration ohne die Notwendigkeit einer Kalibrierung mittels chemisch-physikalischer Eisenmessung in Gewebeproben könnte zukünftig durch die kardio-magnetische Suszeptibilitäts-Messung mit MRI erfolgen (60).
Magnetresonanz-Tomographie von anderen Organen und Geweben
Die fehlende Korrelation der Leber- mit der Herzeisen-Konzentration hat gezeigt, dass die Messung des Lebereisens als alleiniger Indikator für
Eisenmessung in Gewebeproben könnte zukünftig durch die kardio-magnetische Suszeptibilitäts-Messung mit MRI erfolgen (60).
Magnetresonanz-Tomographie von anderen Organen und Geweben
Die fehlende Korrelation der Leber- mit der Herzeisen-Konzentration hat gezeigt, dass die Messung des Lebereisens als alleiniger Indikator für die Erfassung des Komplikationsrisikos durch Eisenüberladung nicht ausreicht. Es kann in bestimmten Organen und Drüsengeweben durch zwar
die Erfassung des Komplikationsrisikos durch Eisenüberladung nicht ausreicht. Es kann in bestimmten Organen und Drüsengeweben durch zwar kleine Eisenmengen zu einer kritischen organ-spezifischen Eisenkonzentration kommen.
Milz
Die Milz kann bei transfundierten Patienten, infolge einer vergrößerten Milz, signifikante Eisenmengen speichern. Im Durchschnitt ist die
kleine Eisenmengen zu einer kritischen organ-spezifischen Eisenkonzentration kommen.
Milz
Die Milz kann bei transfundierten Patienten, infolge einer vergrößerten Milz, signifikante Eisenmengen speichern. Im Durchschnitt ist die Milzeisenkonzentration niedriger als die Lebereisenkonzentration (9), kann aber bei einzelnen Patienten erheblich sein, sodass Änderungen in
Milzeisenkonzentration niedriger als die Lebereisenkonzentration (9), kann aber bei einzelnen Patienten erheblich sein, sodass Änderungen in der Chelatordosis sich in der Leber erst verspätet zeigen. Die Messung der Milzeisenkonzentration ist für Milzvolumina ≥ 400 ml mittels SQUID-
der Chelatordosis sich in der Leber erst verspätet zeigen. Die Messung der Milzeisenkonzentration ist für Milzvolumina ≥ 400 ml mittels SQUID- Biosuszeptometrie möglich und kann die Langzeit-Compliance mit der Chelator-Therapie anzeigen (61).
Hirnanhangsdrüse
Biosuszeptometrie möglich und kann die Langzeit-Compliance mit der Chelator-Therapie anzeigen (61).
Hirnanhangsdrüse  Die vordere Hypophyse scheint am sensitivsten auf frühe toxische Effekte der Eisenüberladung zu reagieren. Dies steht im Zusammenhang mit
Die vordere Hypophyse scheint am sensitivsten auf frühe toxische Effekte der Eisenüberladung zu reagieren. Dies steht im Zusammenhang mit der Beobachtung das 55% der nach 1970 geborenen Thalassämie-Patienten des italienischen Thalassämie-Registers einen Hypogonadismus
der Beobachtung das 55% der nach 1970 geborenen Thalassämie-Patienten des italienischen Thalassämie-Registers einen Hypogonadismus zeigen (5). Die quantitative Messung von Eisen mittels MRI in der relativ kleinen vorderen Hypophyse (200 ± 100 mm3) gestaltet sich als
zeigen (5). Die quantitative Messung von Eisen mittels MRI in der relativ kleinen vorderen Hypophyse (200 ± 100 mm3) gestaltet sich als schwierig. Inwieweit sich die Eisenüberladung der Hypophyse aus der Messung von Ferritin oder dem Lebereisen ableiten lässt, ist eine noch
schwierig. Inwieweit sich die Eisenüberladung der Hypophyse aus der Messung von Ferritin oder dem Lebereisen ableiten lässt, ist eine noch offene Frage, da die bisher eingesetzten MRI-Methoden (SIR) eher als semi-quantitativ bezeichnet werden müssen (62). Ebenso ist der
offene Frage, da die bisher eingesetzten MRI-Methoden (SIR) eher als semi-quantitativ bezeichnet werden müssen (62). Ebenso ist der Zusammenhang zwischen Hypophysen-Funktion (gemessen mit dem Gonadotropin-Test) und einer Eisenüberladung (gemessen mit MRI-T2)
Zusammenhang zwischen Hypophysen-Funktion (gemessen mit dem Gonadotropin-Test) und einer Eisenüberladung (gemessen mit MRI-T2) nicht eindeutig gezeigt (63).
Bauchspeicheldrüse
Eine bei Eisenüberladung häufig anzutreffende Komplikation ist die Glucose-Intoleranz bzw. ein Diabetes mellitus Typ 2, sowohl bei hereditärer
nicht eindeutig gezeigt (63).
Bauchspeicheldrüse
Eine bei Eisenüberladung häufig anzutreffende Komplikation ist die Glucose-Intoleranz bzw. ein Diabetes mellitus Typ 2, sowohl bei hereditärer Hämochromatose als auch bei ß-Thalassaemia major (5, 46). Die Pathogenese des Diabetes im Zusammenhang mit einer Siderose ist nicht
Hämochromatose als auch bei ß-Thalassaemia major (5, 46). Die Pathogenese des Diabetes im Zusammenhang mit einer Siderose ist nicht wirklich verstanden (45, 64). Die Eisenüberladung in der Bauchspeicheldrüse führt zu oxidativem Stress in den Beta-Zellen gefolgt von Zelltod
wirklich verstanden (45, 64). Die Eisenüberladung in der Bauchspeicheldrüse führt zu oxidativem Stress in den Beta-Zellen gefolgt von Zelltod und Glucose-Intoleranz, wobei dieses Szenario allein nicht einen Diabetes zu verursachen scheint (65).
In Patienten mit ß-Thalassamia major wurde mit MRI-T2* ein signifikant höheres Pankreas-zu-Fett SignalVerhältnis als in Normal-Personen
und Glucose-Intoleranz, wobei dieses Szenario allein nicht einen Diabetes zu verursachen scheint (65).
In Patienten mit ß-Thalassamia major wurde mit MRI-T2* ein signifikant höheres Pankreas-zu-Fett SignalVerhältnis als in Normal-Personen gemessen, wobei dieses reziprok mit der Serum-Trypsin-Konzentration korrelierte, was die Autoren mit progressiver Fetteinlagerung als Folge
gemessen, wobei dieses reziprok mit der Serum-Trypsin-Konzentration korrelierte, was die Autoren mit progressiver Fetteinlagerung als Folge der Beta-Zell-Apoptose erklären (66). Signifikante Unterschiede zwischen b-Thalassämie-Patienten mit und ohne Diabetes sind in der
der Beta-Zell-Apoptose erklären (66). Signifikante Unterschiede zwischen b-Thalassämie-Patienten mit und ohne Diabetes sind in der Bauchspeicheldrüse mit MRI-T1–SIR gefunden worden, obgleich diese Ergebnisse durch das Problem der Fetteinlagerung bei progressiver
Bauchspeicheldrüse mit MRI-T1–SIR gefunden worden, obgleich diese Ergebnisse durch das Problem der Fetteinlagerung bei progressiver Pankreasinsuffizienz beeinträchtigt sind.
Andere Drüsen und Gewebe
Die Eiseneinlagerung in andere Organe und Gewebe (Gonaden, Schilddrüse, Gehirn, Niere, Lunge) ist bisher wenig untersucht, wobei den
Pankreasinsuffizienz beeinträchtigt sind.
Andere Drüsen und Gewebe
Die Eiseneinlagerung in andere Organe und Gewebe (Gonaden, Schilddrüse, Gehirn, Niere, Lunge) ist bisher wenig untersucht, wobei den Eisenspeichern im Gehirn bei Sichelzell-Anämien und auch hinsichtlich anderer Krankheiten (Parkinson, Alzheimer) eine besondere Bedeutung
Eisenspeichern im Gehirn bei Sichelzell-Anämien und auch hinsichtlich anderer Krankheiten (Parkinson, Alzheimer) eine besondere Bedeutung zukommt. Eine interessante neuere Methode stellt die Messung der magnetischen Suszeptibilität mit MRI (60) in spezifischen Hirnarealen dar,
zukommt. Eine interessante neuere Methode stellt die Messung der magnetischen Suszeptibilität mit MRI (60) in spezifischen Hirnarealen dar, insbesondere das SWI (= susceptibility weighted imaging), das neben den üblichen Intensitäts-Bildern auch die Phasen-Bilder auswertet (67). Die
Validierung dieser Methoden wird, wie bei der SQUID Biomagnetischen Leber-Suszeptometrie geschehen, ungleich schwieriger werden.
Literatur
37. Fischer R, Engelhardt R, Nielsen P, Gabbe EE, Heinrich HC, Schmiegel WH, Wurbs D. In: Hoke M, Erné SN, Okada YC, Romani GL (Eds.). Advances in
insbesondere das SWI (= susceptibility weighted imaging), das neben den üblichen Intensitäts-Bildern auch die Phasen-Bilder auswertet (67). Die
Validierung dieser Methoden wird, wie bei der SQUID Biomagnetischen Leber-Suszeptometrie geschehen, ungleich schwieriger werden.
Literatur
37. Fischer R, Engelhardt R, Nielsen P, Gabbe EE, Heinrich HC, Schmiegel WH, Wurbs D. In: Hoke M, Erné SN, Okada YC, Romani GL (Eds.). Advances in Biomagnetism '91, Liver iron quantification in the diagnosis and therapy control of iron overload patients. Elsevier, Amsterdam 1992; 585-88
Biomagnetism '91, Liver iron quantification in the diagnosis and therapy control of iron overload patients. Elsevier, Amsterdam 1992; 585-88  38. Ghugre N, Coates TD, Nelson MD, Wood JC. Mechanisms of tissue-iron relaxivity: nuclear magnetic resonance studies of human liver biopsy specimens.
38. Ghugre N, Coates TD, Nelson MD, Wood JC. Mechanisms of tissue-iron relaxivity: nuclear magnetic resonance studies of human liver biopsy specimens. Magn Reson Med 2005; 54:1185-93
Magn Reson Med 2005; 54:1185-93  39. Sheth S, Tang H, Jensen JH, Altmann K, Prakash A, Printz DF, Hordorf AJ, Tosti CL, Azabagic A, Swaminathan S, Brown TR, Olivieri NF, Brittenham GM. MR
39. Sheth S, Tang H, Jensen JH, Altmann K, Prakash A, Printz DF, Hordorf AJ, Tosti CL, Azabagic A, Swaminathan S, Brown TR, Olivieri NF, Brittenham GM. MR measurement of ferritin and hemosiderin iron in patients with iron overload. Ann N Y Acad Sci 2005; 1054:358-78
measurement of ferritin and hemosiderin iron in patients with iron overload. Ann N Y Acad Sci 2005; 1054:358-78  40. Kaltwasser JP, Gottschalk R, Schalk KP, Hartl W. Non-invasive quantitation of liver iron-overload by magnetic resonance imaging. Brit J Haematol 1990;
40. Kaltwasser JP, Gottschalk R, Schalk KP, Hartl W. Non-invasive quantitation of liver iron-overload by magnetic resonance imaging. Brit J Haematol 1990; 74:360-63
74:360-63  41. Engelhardt R, Langkowski JH, Fischer R, Nielsen P, Kooijman H, Heinrich HC, Buecheler E. MRI-sequences for liver iron quantification: studies in aqueous
41. Engelhardt R, Langkowski JH, Fischer R, Nielsen P, Kooijman H, Heinrich HC, Buecheler E. MRI-sequences for liver iron quantification: studies in aqueous iron solutions, iron overloaded rats and patients with hereditary hemochromatosis. Magn Reson Imaging 1994; 12:999-1007
iron solutions, iron overloaded rats and patients with hereditary hemochromatosis. Magn Reson Imaging 1994; 12:999-1007  42. Papakonstantinou OG, Maris TG, Kostaridou V, et al. Assessment of liver iron overload by T2 quantitative magnetic resonance imaging: correlation of T2-
42. Papakonstantinou OG, Maris TG, Kostaridou V, et al. Assessment of liver iron overload by T2 quantitative magnetic resonance imaging: correlation of T2- qMRI measurements with serum ferritin concentration and histologic grading of siderosis. Magn Res Imaging 1995; 13:967-77
qMRI measurements with serum ferritin concentration and histologic grading of siderosis. Magn Res Imaging 1995; 13:967-77  43. St.Pierre TG, Clark PR, Chua-anusorn W, Fleming AJ, Jeffrey GP, Olynyk JK, Pootrakul P, Robins E, Lindeman R. Noninvasive measurement and imaging of
43. St.Pierre TG, Clark PR, Chua-anusorn W, Fleming AJ, Jeffrey GP, Olynyk JK, Pootrakul P, Robins E, Lindeman R. Noninvasive measurement and imaging of liver iron concentrations using proton magnetic resonance. Blood 2005; 105:855-61
liver iron concentrations using proton magnetic resonance. Blood 2005; 105:855-61  44. Wood JC, Enriquez C, Ghugre N, Tyzka JM, Carson S, Nelson MD, Coates TD. MRI R2 and R2* mapping accurately estimates hepatic iron concentration in
44. Wood JC, Enriquez C, Ghugre N, Tyzka JM, Carson S, Nelson MD, Coates TD. MRI R2 and R2* mapping accurately estimates hepatic iron concentration in transfusion-dependent thalassemia and sickle cell disease patients. Blood 2005; 106:1460-65
transfusion-dependent thalassemia and sickle cell disease patients. Blood 2005; 106:1460-65  45. Brittenham GM, Griffith PM, Nienhuis AW, McLaren CE, Young NS, Tucker EE, Allen CJ, Farrell DE , Harris JW. Efficacy of deferoxamine in preventing
45. Brittenham GM, Griffith PM, Nienhuis AW, McLaren CE, Young NS, Tucker EE, Allen CJ, Farrell DE , Harris JW. Efficacy of deferoxamine in preventing complications of iron overload in patients with thalassemia major. N Engl J Med 1994; 331:567-73
complications of iron overload in patients with thalassemia major. N Engl J Med 1994; 331:567-73  46. Strohmeyer G, Niederau C, Stremmel W. Survival and causes of death in hemochromatosis. Observations in 163 patients. Ann N Y Acad Sci 1988; 526:245-
46. Strohmeyer G, Niederau C, Stremmel W. Survival and causes of death in hemochromatosis. Observations in 163 patients. Ann N Y Acad Sci 1988; 526:245- 57
47. Jensen PD, Jensen FT, Christensen T, Heickendorff L, Jensen LG, Ellegaard J. Indirect evidence for the potential ability of magnetic resonance imaging to
57
47. Jensen PD, Jensen FT, Christensen T, Heickendorff L, Jensen LG, Ellegaard J. Indirect evidence for the potential ability of magnetic resonance imaging to evaluate the myocardial iron content in patients with transfusional iron overload. MAGMA 2001; 12:153-66
evaluate the myocardial iron content in patients with transfusional iron overload. MAGMA 2001; 12:153-66  48. Anderson LJ, Wonke B, Prescott E, Holden S, Walker JM, Pennell DJ. Comparison of effects of oral deferiprone and subcutaneous desferrioxamine on
48. Anderson LJ, Wonke B, Prescott E, Holden S, Walker JM, Pennell DJ. Comparison of effects of oral deferiprone and subcutaneous desferrioxamine on myocardial iron concentrations and ventricular function in beta-thalassaemia. Lancet 2002; 360(9332):516-20
myocardial iron concentrations and ventricular function in beta-thalassaemia. Lancet 2002; 360(9332):516-20  49. Pennell DJ, Berdoukas V, Karagiorga M, Ladis V, Piga A, Aessopos A, Gotsis ED, Tanner MA, Smith GC, Westwood MA, Wonke B, Galanello R. Randomized
49. Pennell DJ, Berdoukas V, Karagiorga M, Ladis V, Piga A, Aessopos A, Gotsis ED, Tanner MA, Smith GC, Westwood MA, Wonke B, Galanello R. Randomized controlled trial of deferiprone or deferoxamine in beta-thalassemia major patients with asymptomatic myocardial siderosis. Blood 2005; 107:3738-3744
controlled trial of deferiprone or deferoxamine in beta-thalassemia major patients with asymptomatic myocardial siderosis. Blood 2005; 107:3738-3744  50. Fitchett DH, Coltart DJ, Littler WA, Leyland MJ, Trueman T, Gozzard DI, Peters TJ. Cardiac involvement in secondary haemochromatosis: a catheter biopsy
50. Fitchett DH, Coltart DJ, Littler WA, Leyland MJ, Trueman T, Gozzard DI, Peters TJ. Cardiac involvement in secondary haemochromatosis: a catheter biopsy study and analysis of myocardium. Cardiovasc Res 1980; 14:719-24
study and analysis of myocardium. Cardiovasc Res 1980; 14:719-24  51. Barosi O, Arbustini E, Gavazzi A, Grasso M, Pucci A. Myocardial iron grading by endomyocardial biopsy. A clinico-pathologic study on iron overloaded
51. Barosi O, Arbustini E, Gavazzi A, Grasso M, Pucci A. Myocardial iron grading by endomyocardial biopsy. A clinico-pathologic study on iron overloaded patients. Eur J Haematol 1989; 42:382-88
patients. Eur J Haematol 1989; 42:382-88  52. Buja LM, Roberts WC. Iron in the heart. Etiology and clinical significance. Am J Med 1971; 51:209-21
52. Buja LM, Roberts WC. Iron in the heart. Etiology and clinical significance. Am J Med 1971; 51:209-21  53. Olson LJ, Edwards WD, McCall JT, Ilstrup DM, Gersh BJ. Cardiac iron deposition in idiopathic hemochromatosis: histologic and analytic assessment of 14
53. Olson LJ, Edwards WD, McCall JT, Ilstrup DM, Gersh BJ. Cardiac iron deposition in idiopathic hemochromatosis: histologic and analytic assessment of 14 hearts from autopsy. J Am Coll Cardiol 1987; 10:1239-43
hearts from autopsy. J Am Coll Cardiol 1987; 10:1239-43  54. Sonakul D, Thakerngpol K, Pacharee P. Cardiac pathology in 76 thalassemic patients. Birth Defects Orig Artic Ser 1988; 23:177-91
54. Sonakul D, Thakerngpol K, Pacharee P. Cardiac pathology in 76 thalassemic patients. Birth Defects Orig Artic Ser 1988; 23:177-91  55. Ghugre NR, Enriquez CM, Coates TD, Nelson MD Jr, Wood JC. Improved R2* measurements in myocardial iron overload. J Magn Reson Imaging 2006; 23:9-
55. Ghugre NR, Enriquez CM, Coates TD, Nelson MD Jr, Wood JC. Improved R2* measurements in myocardial iron overload. J Magn Reson Imaging 2006; 23:9- 16
56. Westwood M, Anderson LJ, Firmin DN, Gatehouse PD Charrier CC, Wonke B, Pennell DJ. A single breath-hold multiecho T2* cardiovascular magnetic
16
56. Westwood M, Anderson LJ, Firmin DN, Gatehouse PD Charrier CC, Wonke B, Pennell DJ. A single breath-hold multiecho T2* cardiovascular magnetic resonance technique for diagnosis of myocardial iron overload. J Mag Reson Imag 2003; 18:33-39
resonance technique for diagnosis of myocardial iron overload. J Mag Reson Imag 2003; 18:33-39  57. Wood JC, Otto-Duessel M, Aguilar M, Nick H, Nelson MD, Coates TD, Pollack H, Moats R. Cardiac iron determines cardiac T2*, T2, and T1 in the gerbil
57. Wood JC, Otto-Duessel M, Aguilar M, Nick H, Nelson MD, Coates TD, Pollack H, Moats R. Cardiac iron determines cardiac T2*, T2, and T1 in the gerbil model of iron cardiomyopathy. Circulation 2005; 112:535-43
model of iron cardiomyopathy. Circulation 2005; 112:535-43  58. Mavrogeni SI, Markussis V, Kaklamanis L, Tsiapras D, Paraskevaidis I, Karavolias G, Karagiorga M, Douskou M, Cokkinos DV, Kremastinos DT. A comparison
58. Mavrogeni SI, Markussis V, Kaklamanis L, Tsiapras D, Paraskevaidis I, Karavolias G, Karagiorga M, Douskou M, Cokkinos DV, Kremastinos DT. A comparison of magnetic resonance imaging and cardiac biopsy in the evaluation of heart iron overload in patients with beta-thalassemia major. Eur J Haematol 2005;
of magnetic resonance imaging and cardiac biopsy in the evaluation of heart iron overload in patients with beta-thalassemia major. Eur J Haematol 2005; 75:241-47
75:241-47  59. Westwood MA, Sheppard MN, Awogbade M, Ellis G, Stephens AD, Pennell DJ. Myocardial biopsy and T2* magnetic resonance in heart failure due to
59. Westwood MA, Sheppard MN, Awogbade M, Ellis G, Stephens AD, Pennell DJ. Myocardial biopsy and T2* magnetic resonance in heart failure due to thalassaemia. Brit J Haematol 2004; 128:2
thalassaemia. Brit J Haematol 2004; 128:2  60. Wang ZJ, Lian L, Chen Q, Asakura T, Zhao H, Cohen AR. 1/T2 and magnetic susceptibility measurements in a gerbil cardiac iron overload model. Radiology
60. Wang ZJ, Lian L, Chen Q, Asakura T, Zhao H, Cohen AR. 1/T2 and magnetic susceptibility measurements in a gerbil cardiac iron overload model. Radiology 2005; 234:749-55
2005; 234:749-55  61. Fischer R. Liver iron susceptometry. In: Andrä W, Nowak H (Eds.). Magnetism in Medicine - a Handbook. Wiley-VCH , Berlin 1998; 286-301
61. Fischer R. Liver iron susceptometry. In: Andrä W, Nowak H (Eds.). Magnetism in Medicine - a Handbook. Wiley-VCH , Berlin 1998; 286-301  62. Argyropoulou MI, Kiortsis DN, Efremidis SC. MRI of the liver and the pituitary gland in patients with beta-thalassemia major: does hepatic siderosis
62. Argyropoulou MI, Kiortsis DN, Efremidis SC. MRI of the liver and the pituitary gland in patients with beta-thalassemia major: does hepatic siderosis predict pituitary iron deposition? Eur Radiol 2003;13:12-6
predict pituitary iron deposition? Eur Radiol 2003;13:12-6  63. Berkovitch M, Bistritzer T, Milone SD, Perlman K, Kucharczyk W, Olivieri NF. Iron deposition in the anterior pituitary in homozygous beta-thalassemia: MRI
63. Berkovitch M, Bistritzer T, Milone SD, Perlman K, Kucharczyk W, Olivieri NF. Iron deposition in the anterior pituitary in homozygous beta-thalassemia: MRI evaluation and correlation with gonadal function. J Pediatr Endocrinol Metab 2000; 13:179-84
evaluation and correlation with gonadal function. J Pediatr Endocrinol Metab 2000; 13:179-84  64. Cario H, Holl RW, Debatin KM, Kohne E. Insulin sensitivity and beta-cell secretion in thalassaemia major with secondary haemochromatosis: assessment
64. Cario H, Holl RW, Debatin KM, Kohne E. Insulin sensitivity and beta-cell secretion in thalassaemia major with secondary haemochromatosis: assessment by oral glucose tolerance test. Eur J Pediatr 2003; 162:139-46
by oral glucose tolerance test. Eur J Pediatr 2003; 162:139-46  65. Cooksey RC, Jouihan HA, Ajioka RS, Hazel MW, Jones DL, Kushner JP, McClain DA. Oxidative stress, beta-cell apoptosis, and decreased insulin secretory
65. Cooksey RC, Jouihan HA, Ajioka RS, Hazel MW, Jones DL, Kushner JP, McClain DA. Oxidative stress, beta-cell apoptosis, and decreased insulin secretory capacity in mouse models of hemochromatosis. Endocrinology 2004; 145:5305-12
capacity in mouse models of hemochromatosis. Endocrinology 2004; 145:5305-12  66. Midiri M, Lo Casto A, Sparacia G, D’Angelo, P, Malizia R, Finazzo M, Montalto G, Solbiati L, Lagalla R, De Maria M. MR imaging of pancreatic changes in
66. Midiri M, Lo Casto A, Sparacia G, D’Angelo, P, Malizia R, Finazzo M, Montalto G, Solbiati L, Lagalla R, De Maria M. MR imaging of pancreatic changes in patients with transfusion dependent b-thalassemia major. Am J Roentgenol 1999; 173:187-92
patients with transfusion dependent b-thalassemia major. Am J Roentgenol 1999; 173:187-92  67. Haacke EM, Cheng NY, House MJ, Liu Q, Neelavalli J, Ogg RJ, Khan A, Ayaz M, Kirsch W, Obenaus A. Imaging iron stores in the brain using magnetic
67. Haacke EM, Cheng NY, House MJ, Liu Q, Neelavalli J, Ogg RJ, Khan A, Ayaz M, Kirsch W, Obenaus A. Imaging iron stores in the brain using magnetic resonance imaging. Magn Reson Imaging 2005; 23:1-25
resonance imaging. Magn Reson Imaging 2005; 23:1-25 


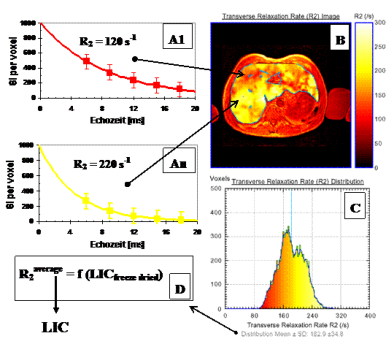











© www.eiseninfo.de
Diagnostik bei Eisenüberladung
Die Magnetoresonanztomographie (MRT) ist
eine der wichtigsten diagnostischen Verfahren in der
Radiologie. In Deutschlang gibt es inzwischen MRT-
Geräte auch in fast allen Kleinstätten. Seit ca. 30
Jahren haben vielen Gruppen versucht, Eisen in
Geweben mit MRT zu messen und zu quantifizieren. Es
gibt inzwischen auch einige Methoden, die dies auch
grundsätzlich können (s. unten). Diese Methoden sind
aber aufwendig (besonders was die Auswertung angeht)
und sind meist auch gerätebezogen was eine breite
Anwendung in der Routine bis heute verhindert hat. Der
beondere Charme der MRT Methoden ist die Vielzahl
der Maschinen weltweit und die Möglichkeit, Eisen in
praktisch allen interessanten geweben zu quantifizieren
(Leber, Herz, Pankreas, Knochenmakr, Gehirn).

Eisenüberladung
Messung der Lebereisenkonzentration mit dem Hamburger Biomagnetomer





















